|
|
Versión
abandonada! Se reemplazó por la página
https://www.med-informatica.com/SITDIS/SITDIS_Inicio.htm
Esta página se
conserva como depósito de materiales gráficos
PFN
en Proyecto Ley Reglamentaria LES de la ANM
La Política
Farmacéutica Nacional PFN en la Ley Reglamentaria de la LES debe:
1) Preservar las fortalezas de los avances
existentes hoy, 2) Corregir las inconsistencias y fragmentación,
3) Ampliar su utilidad pública, 4) Maximizar los mecanismos de
transparencia y 5) Mejorar los resultados en salud.
Las metas de la Política Farmacéutica Nacional 2012 a 2021

El
CONPES 155 del 30 de agosto de 2012 llamado de Política
Farmacéutica Nacional (PFN) hizo parte de la primavera
normativa que culminó con la expedición de la
Ley 1751 de 16 de febrero de 2015 y Sentencia C-313 de 2014
o Ley Estatutaria de Salud (LES). Al revisar el nivel de
cumplimiento de 12 indicadores de sus metas, puede verse que
-entre los indicadores de resultados- la meta del 100% en Porcentaje de entrega suficiente y oportuna de medicamentos
no se cumplió en 2014 ni se cumple en 2021. La meta de reducir
los Gastos por eventos no incluidos en plan de beneficios
(prestaciones NoPOS) de 2,4 billones a medio billón terminó
siendo utópica, porque la suma de 2,4 billones solo logró
estabilizarse por un por de años, para luego seguir su
crecimiento incontenible, hasta que la nueva administración optó
por intentar enmascarar este fenómeno con el mecanismo de Techos
o Presupuestos Máximos. Sobre los demás indicadores de
resultados y los 6 de gestión, puede decirse que tuvieron un
cumplimiento medio con inconsistencias. Resaltamos
aquí las principales incumplimientos que limitaron y siguen
limitando el logro de resultados.
TEMARIO:
1.
Incumplimientos que afectan a las prescripciones médicas
1.1.
Inconsistencias de las Plataformas MI-PRES y SISMED
1.2.
Inconsistencias en las Plataformas MI-PRES, SISMED e INVIMA
1.3.
Inconsistencias de la base de datos del INVIMA
1.4.
Diseño inadecuado del acceso a la Base de Datos del INVIMA
2.
Debate: PFN
en Proyecto Ley Reglamentaria LES 2022
2.1.
Fue imposible
obtener el microdato de la información de recobros (hasta
hoy)
2.2.
Inconsistencias y falta de transparencia afectan credibilidad de
MinSalud
2.3.
Inconsistencias y falta de transparencia afectan últimas medidas
de MinSalud
3.
Propuestas: PFN
en Proyecto Ley Reglamentaria LES 2022
3.1.
Acuerdo No. 15: Política Farmacéutica en Proyecto ANM
3.2.
Política Farmacéutica e Innovaciones Tecnológicas en Salud
CSR-FMC
1.
Incumplimientos que afectan las prescripciones médicas
Sin duda, los incumplimientos más importantes de la PFN de 2012
están relacionados con las prescripciones médicas, es decir
-paradójicamente- con los gestores en Colombia
de uno de los mayores logros legislativos en materia de Derecho
Fundamental a la Salud, alcanzado por organización médica alguna
a nivel mundial.
1.1.
Inconsistencias de las Plataformas MI-PRES y SISMED
El
núcleo de la prescripción y uso de tecnologías en salud está en
los médicos cuya autonomía y autorregulación se proclama en la
LES. Mostramos aquí un par de ejemplos del impacto, algunas
inconsistencias de la base de datos de precripciones y la falta
de seguimiento a los resultados en salud.
Ventas y prescripciones de
PEMBROLIZUMAB uno de los biotecnológicos más importantes según
últimos reportes a SISMED

PEMBROLIZUMAB (KEYTRUDA 100 mg) introducida por GLAXOSMITHKLINE
y hoy comercializada por MERCK&CO_MS&D, es uno de los
Biotecnológicos con mayor dinamismo de ventas, según los últimos
reportes a SISMED. Tiene ventas acumuladas de casi $ 500.000
millones en los últimos 5 años, Está protegido por Decreto
2085 hasta el 20 de febrero de 2022. Muestra datos exorbitantes
en Transacciones Finales (cobros y recobros) en el trimestre 1°
de 2020. Presenta prescripciones importantes de cinco (5)
prestadores cuyos nombres y apellidos de personal natural
aparecen como IPSs. Algunos hechos que MinSalud debería
confirmar y explicar son:
¿Las
prescripciones de PEMBROLIZUMAB (KEYTRUDA de MERCK&CO_MS&D) se
concentran más en regiones como Bogotá, Antioquia y
Cesar-Córdoba? ¿Por qué?

Es poco creíble que en Cesar y Córdoba existan más casos de
MELANOMA NO RESECABLE O METASTÁSICO o CARCINOMA DE PULMÓN DE
CÉLULAS NO PEQUEÑAS, que en regiones de mucha mayor densidad
poblacional. ¿Es posible que exista a este nivel un fenómeno
similar al de Factores Antihemofílicos?.
¿Las
prescripciones de PEMBROLIZUMAB (KEYTRUDA de MERCK&CO_MS&D)
están muy concentradas en la IPS FUNDACIÓN COLOMBIANA DE
CANCEROLOGÍA CLÍNICA VIDA? ¿Cuál sería la explicación?

Si -por ejemplo- las prescripciones de PEMBROLIZUMAB del 2°
trimestre de 2021 se hubiesen concentrado en una IPS llamada
FUNDACIÓN COLOMBIANA DE CANCEROLOGÍA CLÍNICA VIDA y su número
fuese de 120, frente a solo 14 de la CLÍNICA MEDELLÍN OCCIDENTE,
10 de la FUNDACIÓN HOSPITALARIA SAN VICENTE DE PAUL y 10 de un
prestador llamado JUAN ALEJO JIMÉNEZ OROZCO ¿Cuál sería la
explicación de este fenómeno?.
¿Las
prescripciones de PEMBROLIZUMAB (KEYTRUDA de MERCK&CO_MS&D) se
concentran en EPS SURA y SANITAS?

Al igual que en el 2° trimestre de 2021, el sorprendente
crecimiento de prescripciones de PEMBROLIZUMAB (KEYTRUDA de
MERCK&CO_MS&D) ¿se concentra más en EPS SURA y SANITAS? ¿Cuál
sería la explicación?
Informe
con recursos
empleados por DNGJ que muestra hechos que el Ministerio de
Salud puede y debería mostrar en forma sistemática y periódica
¿Por
qué en los reportes SISMED de Transacciones Finales del
trimestre 1° de 2020 aparecen recobros por la exorbitante suma
de casi 220.000 millones con precio unitario de casi 200
millones cada Vial?

En los reportes SISMED de
Transacciones Finales del trimestre 1° de 2020 aparecen recobros
por la astronómica suma de casi 220.000 millones con
precio unitario de casi 200 millones cada Vial. Si se
trata de un error de reporte ¿es que SISMED no tiene malla de
validación?
1.2.
Inconsistencias en las Plataformas MI-PRES, SISMED e INVIMA
Además de inconsistencias
similares a las del anterior biotecnológico PEMBROLIZUMAB, en
este otro ejemplo vemos que TOCILIZUMAB -con indicación aprobada
hace más de una década para Artritis Reumatoide- fue empleado en
el tratamiento de COVID y obviamente mostró un aumento
considerable de prescripciones y ventas reportadas a SISMED. Lo
lamentable es que en este y muchos casos se añaden las
inconsistencias de la base de datos del INVIMA y más lamentable
aún es que sobre la mayor parte de medicamentos y tecnologías
empleadas para diagnóstico y tratamiento durante la pandemia, no
se tiene información pública -ni clínica ni económica- y lo poco
que existe tiene inconsistencias graves.
Ventas y prescripciones de TOCILIZUMAB el único
biotecnológico con datos de uso en la Pandemia de COVID-19

TOCILIZUMAB (ACTEMRA de ROCHE) es el único Biotecnológico con
datos de uso reportado durante la Pandemia de COVID-19. Según
datos reportados a SISMED. tuvo ventas acumuladas de casi $
360.000 millones en los últimos 10 años, Su uso como
tratamiento de la tormenta inflamatoria producida por el virus
SARS-CoV-2 estimuló su prescripción y ventas, siendo
prácticamente el único caso donde el sistema de información no
fue anulado para evitar controles. Su protección por Decreto
2085 está vencida desde el 10 de julio de 2014, pero aún no
tiene competidores en el mercado colombiano. En SISMED, presenta
datos exorbitantes de Transacciones Finales (cobros y recobros)
en el trimestre 1° de 2020. Algunos hechos que el Ministerio
de Salud debería
confirmar y explicar son:
Si el
mayor número de prescripciones de TOCILIZUMAB (ACTEMRA de ROCHE)
en 2017 correspondía a Artritis Reumatoide y en 2020 a
CORONAVIRUS ¿Por qué en 3T2021 la mayor cantidad de prescripciones
corresponde a diagnóstico "NO DEFINIDO"?

Si el mayor número de prescripciones de TOCILIZUMAB (ACTEMRA de
ROCHE) en 2017 correspondía a Artritis Reumatoide y en 2020 a
CORONAVIRUS ¿Por qué en 3T21 la mayor cantidad de prescripciones
tiene diagnóstico "NO DEFINIDO"? ¿Acepta el aplicativo Mi-Pres
prescripciones de alto costo sin diagnóstico definido?
¿Por
qué el prestador ART MEDICA SAS mostró picos de mayor
prescripción de TOCILIZUMAB (ACTEMRA de ROCHE) tanto en 2017
como en 2020,
durante la Pandemia de COVID-19?

El prestador ART MEDICA SAS mostró picos de mayor prescriptor de
TOCILIZUMAB (ACTEMRA de ROCHE) en 2017 y en 2020 durante la
Pandemia de COVID-19 ¿Cuáles serían las tazones para semejante
concentración de prescripciones con este prestador?
¿Por
qué el número de prescripciones de TOCILIZUMAB (ACTEMRA de
ROCHE) tuvo un salto extraordinario (122) el 2° trimestre de
2020 en Atlántico? y ¿Por qué las demás prescripciones se
concentraron en Bogotá (47) Antioquia (30) y Bolívar (23)?

El número de prescripciones de TOCILIZUMAB (ACTEMRA de ROCHE)
tuvo un salto extraordinario (122) el 2° trimestre de 2020 en
Atlántico y las demás prescripciones se concentraron en Bogotá
(47) Antioquia (30) y Bolívar (23) ¿Cuál sería la explicación? y
¿Por qué las prescripciones se concentraron en Antioquia,
Atlántico y Bogotá?
¿Por
qué las prescripciones de TOCILIZUMAB (ACTEMRA de ROCHE) se
concentraron en EPS SURA, SANITAS y NUEVA EPS?

Si las prescripciones de TOCILIZUMAB (ACTEMRA de ROCHE) siguen
concentradas en un reducido número de EPSs ¿Cuáles son las
causas para esta concentración? ¿Y cuáles sus implicaciones
epidemiológicas y económicas?
Informe
con recursos
empleados por DNGJ que muestra hechos que el Ministerio de
Salud puede y debería mostrar en forma sistemática y periódica
¿Por
qué el reporte SISMED del trimestre 1° de 2020 muestra
Transacciones Secundarias por la increíble suma de 7,7 BILLONES?
¿Existen Transacciones Finales (cobros y recobros) por millones
de unidades sin valor comercial? ¿Cómo debe reportarse el valor
comercial de una presentación que el INVIMA define como "Tanque
de 500 a 5000 metros cúbicos"?

El reporte SISMED del
trimestre 1° de 2020 de OXIGENO MEDICINAL CUM 50423-17 de
OXIGENOS_COLOMBIA muestra Transacciones Secundarias por la
increíble suma de $ 7,7 BILLONES. Además Transacciones Finales
(cobros y recobros) del 2° trimestre de 2021 por millones de
unidades con valor "0" (¿sin valor comercial?). ¿Es posible que
estas inconsistencias sean generadas por el propio INVIMA que
define presentaciones imprecisas como "Tanque de 500 m3
hasta 50000 m3 y similares"?
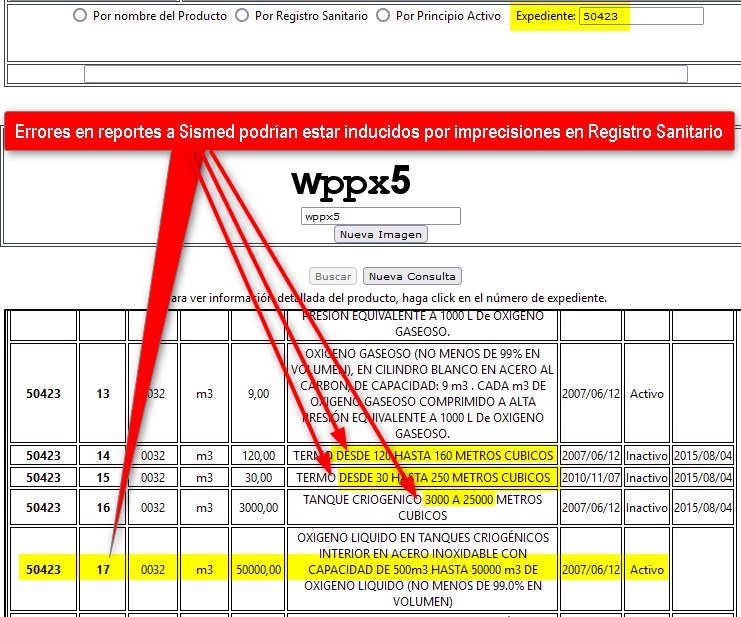
Estas
inconsistencias demuestran que SISMED no cuenta con mallas de validación
de la información o -si existen- son extremadamente
ineficientes. Además ¿Por qué el INVIMA
no corrige las inconsistencias de su base de datos,,,por lo
menos las de mayor impacto económico, las que afectan los
reportes a SISMED y los que afectan las prescripciones de la plataforma MI-PRES?
1.3. Inconsistencias
misionales en la base de datos del INVIMA
Pero hay inconsistencias
más graves en la base de datos del INVIMA que pueden
considerarse "misionales" porque afectan su papel de defensa de
los intereses de la salud pública. Para explicar estos casos,
veamos el siguiente ejemplo: En 1976 año de la
creación de la la Comisión Revisora de Productos Farmacéuticos
el laboratorio más importante en ventas en Colombia era MS&D-Frosst
que con unos 10 principios activos comercializaba más de 50
productos, entre ellos el antihistamínico CIPROHEPTADINA que se
promocionaba con la marca PERIACTIN. Dado su efecto secundario
estimulante del apetito había introducido PERIACTIN BC con
Vitaminas B y C además de PERIACTIN-VITA con más vitaminas. Por
la línea Frosst había lanzado también APETIGEN y APETIGEN V8 con
8 vitaminas. Adicionalmente, asociando CIPROHEPTADINA con otra
molécula de su propiedad -DEXAMETASONA- había lanzado PERIDEX,
contribuyendo así a su evidente éxito económico. La naciente
Comisión Revisora, en clara muestra de independencia y
solidez científica, se atrevió a prohibir la indicación
"estimulante del apetito" para los antihistamínicos, su
asociación con vitaminas y la asociación fija de antihistamínicos
con corticoides, tal como puede verse en la quinta edición de
Normas Farmacológicas de 1993
ARMI publicada por el Ministerio de Salud y el Instituto
Nacional de Salud INS. Estas normas siguen vigentes, tal como
puede verse en la
Actualización
ARMI publicada por el INVIMA en junio de 2019. Las muestras
de independencia y
solidez científica parecen ser del pasado, porque actualmente se
están adoptando decisiones cuestionables, de alto
impacto, dudosa solidez científica y claro beneficio para el
interés comercial de las grandes farmacéuticas, como puede verse
en los siguientes ejemplos:
Inconsistencias del
caso LIRAGLUTIDA que ya lleva reportes de ventas por 600.000 millones
LIRAGLUTIDA de NovoNordisk se
introdujo en 2013 como VICTOZA 6 mg / mL (con Protección del
Decreto 2085 vencida en 09abr18) para tratamiento de Diabetes.
En 2018 NovoNordisk
introdujo SAXENDA 6 mg / mL (el mismo
principio activo, en la misma concentración y por el mismo
laboratorio) para tratamiento de la Obesidad, sin que esa
indicación aparezca en la Clasificación ATC de la OMS, ni sea
mencionada como aceptada en las Normas Farmacológicas vigentes
en Colombia. Además, con Norma Farmacológica de aprobación FALSA
en la Resolución que le concedió el Registro Sanitario:

Nótese que
en las
Normas Farmacológicas actualizadas
en junio de 2019
ARMI la Norma 8.2.3.0.N10 no es de aprobación LIRAGLUTIDA
sino de retiro de algunos Hipoglicemiantes orales e Insulinas:

Y no existe ninguna comunicación posterior del INVIMA que
modifique esta situación. Ver la
Resolución 2018001856
ARMI
Beneficio indudable para
NovoNordisk que más que duplicó sus ventas reportadas a SISMED
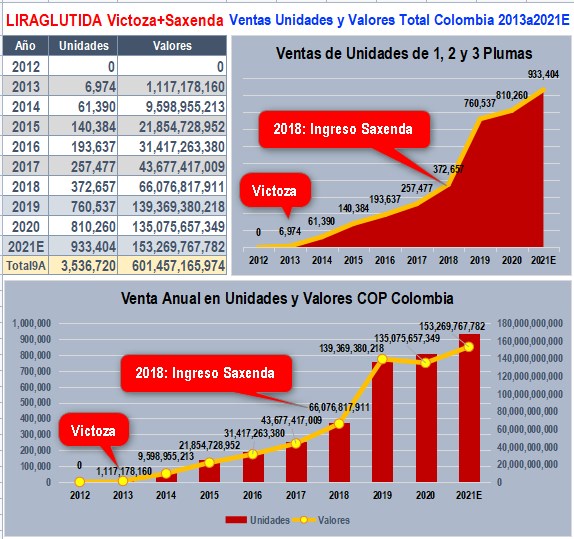
Innegable el salto en las ventas reportadas por NovoNordisk a
SISMED con el ingreso de SAXENDA en 2018
En indicaciones, el Registro Sanitario de VICTOZA 6 mg / mL
dice textualmente: "NUEVAS
INDICACIONES: LIRAGLUTIDA ESTÁ INDICADO COMO COMPLEMENTO DE LA
DIETA Y EL EJERCICIO PARA LOGRAR UN CONTROL GLUCÉMICO EN ADULTOS
CON DIABETES MELLITUS TIPO 2. LIRAGLUTIDA ESTÁ INDICADO PARA UNA
ADMINISTRACIÓN UNA VEZ AL DÍA: - TRATAMIENTO EN MONOTERAPIA O
COMBINADO CON UNO O MÁS ANTIDIABÉTICOS ORALES (METFORMINA,
SULFONILUREAS O TIAZOLIDINEDIONA) CUANDO EL TRATAMIENTO CON
METFORMINA NO CONSIGUE UN CONTROL GLUCÉMICO ADECUADO. -
TRATAMIENTO COMBINADO CON INSULINA EN PACIENTES QUE NO LOGRAN UN
ADECUADO CONTROL GLUCÉMICO, CON LIRAGLUTIDA Y METFORMINA - PARA
REDUCIR EL RIESGO DE MUERTE CARDIOVASCULAR EN PACIENTES ADULTOS
CON DIABETES MELLITUS TIPO 2 Y ALTO RIESGO CARDIOVASCULAR
ACOMPAÑADO DE OTRAS MEDIDAS QUE REDUZCAN EL RIESGO
CARDIOVASCULAR. SIN EMBARGO, NO SE HA DEMOSTRADO LA EFICACIA DE
LIRAGLUTIDA PARA REDUCIR EL RIESGO DE INFARTO DE MIOCARDIO NO
FATAL O ACCIDENTE CEREBROVASCULAR NO FATAL EN ADULTOS CON
DIABETES MELLITUS TIPO 2."
En indicaciones, el Registro Sanitario de
SAXENDA 6 mg / mL
dice textualmente: "SAXENDA®
ESTÁ INDICADO EN COMBINACIÓN A UNA DIETA BAJA EN CALORÍAS Y EL
AUMENTO DE LA ACTIVIDAD FÍSICA, PARA EL MANEJO CRÓNICO DEL PESO
EN PACIENTES ADULTOS CON UN ÍNDICE DE MASA CORPORAL (IMC)
INICIAL DE: - ?30 KG/M2 O SUPERIOR (OBESIDAD), O - ?27 KG/M2 A
<30 KG/M2 (SOBREPESO) EN PRESENCIA DE AL MENOS UNA COMORBILIDAD
RELACIONADA CON EL PESO COMO DISGLUCEMIA (PRE-DIABETES Y
DIABETES MELLITUS TIPO 2), HIPERTENSIÓN, DISLIPIDEMIA, O APNEA
OBSTRUCTIVA DEL SUEÑO." Preguntas:
¿Por qué SAXENDA, con el mismo principio activo, la misma concentración y
el mismo Laboratorio de VICTOZA, tiene indicaciones distintas en el Registro Sanitario?
¿Por qué usó la Clasificación ATC inadecuada? ¿Por qué apoyó su
autorización en una Norma Farmacológica errada?
Más preguntas:
Todas y cada una de las
Resoluciones de aprobación de Registro Sanitario incluyen la
siguiente: "NOTA DE FARMACOVIGILANCIA: Los reportes e
informes de farmacovigilancia deben presentarse a la Dirección
de Medicamentos y Productos Biológicos con la periodicidad
establecida en la Resolución Nº 2004009455 del 28 de mayo de
2004." La pregunta es: ¿Existe un seguimiento o informe
público de esos reportes e informes? ¿Dónde puede verse?
BEVACIZUMAB:
Si las indicaciones oftalmológicas de BEVACIZUMAB están
tan difundidas ¿Por qué en ninguno de los registros sanitarios
de este principio activo aparecen aprobadas dichas indicaciones
oftalmológicas?
El INVIMA afirma que recibió
reconocimiento internacional como entidad reguladora de primer
nivel. En la práctica, esta afirmación solo se basa en la
aplicación de la política de
“integración profunda con dientes” prevista en el
TLC con USA, traducida
en maximizar las exigencias para certificación en Buenas Prácticas de Manufactura BPM, con
"altos estándares" que someten a los
fabricantes nacionales de competidores genéricos a un "stress
financiero" que terminó desvalorizando sus empresas y les obligó a
venderlas a las multinacionales
farmacéuticas que se apropiaron de su infraestructura y sus ventas institucionales.
Las pocas farmacéuticas nacionales que sobrevivieron a esta
política pública, terminaron adoptando prácticas de promoción y
publicidad de "marcas comerciales" de las multinacionales, que
trasladan costos innecesarios -a veces absurdos- al gasto de
bolsillo de los pacientes.
En cumplimiento de la LES el INVIMA debe adelantar políticas de mejor información y
educación sanitaria para la población, exigir mayor
transferencia de tecnología y contribuir al desarrollo de
capacidades nacionales crecientes en pro de mayor soberanía
farmacéutica.
Este punto sigue en construcción.
Envíe sus sugerencias y observaciones al correo
observamed.fmc@gmail.com
1.4.
Diseño
inadecuado del acceso a la Base de Datos del INVIMA
No pretendemos aquí la
inclusión de detalles menores de diseño en la exposición de
motivos de un proyecto de Ley. Solo mostramos algo de la
evidencia fáctica que debe motivar el marco legislativo que
garantice la solución y no repetición de inconsistencias e
insuficiencias.
Con
demasiada frecuencia, las páginas del INVIMA -que deberían ser
muy rápidas y eficientes para consulta durante la prescripción
en la plataforma MiPres- tiene problemas serios de acceso por
insuficiencia tecnológica ¿Por qué no se implementan soluciones
tecnológicas de estabilidad y alto tráfico que otras plataformas
ya implementaron?

¿Por qué el acceso a la información de Registros Sanitarios de
MEDICAMENTOS y BIOLÓGICOS mantiene un sistema de validación que
ni la FDA, EMA, ni ninguna agencia reguladora ya utiliza? ¿Por
qué ciertas consultas llevan a vacíos de información en lugar de
mensajes de error?

¿Por qué los campos clave para
identificación y búsqueda siguen sin parametrización? ¿Por qué
TODAS las activaciones del número del expediente -que deben
llevar al detalle del registro sanitario- llevan al mensaje
"Consulta en construcción"?
Estamos casi a 5 años del Decreto de Apertura de Competencia de
Biotecnológicos ¿y aún no podemos acceder por esta vía a
detalles del registro sanitario? ¿Acaso no son los
Biotecnológicos los medicamentos de mayor complejidad, donde la
necesidad de información para detalles de la prescripción es
mucho mayor?

¿Por qué la columna de TITULAR del registro
sanitario que existe en la consulta de MEDICAMENTOS se eliminó
de la consulta de BIOLÓGICOS?
¿Por qué no aparecen las fechas de
vencimiento en los registros "Vencidos", "En trámite de
renovación", "Pérdida de fuerza ejecutoria", etc., precisamente
cuando son necesarias -por ejemplo- para identificar reportes a
SISMED con RS inválido?

¿Por qué
los Medicamentos Biotecnológicos -que son los de mayor impacto y
conflictos- no tienen la mejor información?
¿Por qué
incluso en la plataforma "MEDICAMENTOS A UN CLIC" de información
farmacológica para prescribir, son muchos los Biotecnológicos
donde solo dice "Contenido en construcción"?

2.
Debate: PFN
en Proyecto Ley Reglamentaria LES 2022
Los ejemplos
mencionados en el punto anterior, muestran tanto las inconsistencias de la información
almacenada en las diferentes plataformas relacionadas con la
información farmacológica, regulatoria y económica del sistema
de salud, como la falta de un manejo integrado de dicha información. Están aquí para resaltar
la urgencia de un
Sistema
Único e Integrado de Información en Salud, que sea público
y gestione datos abiertos de todo el sistema,
en forma cada vez más integrada entre sí y con
los demás subsistemas de información que incluyan temas
relativos a la salud. Los avances tecnológicos ya existentes en
Big Data e Inteligencia Artificial, ya permiten generar información
estratégica en beneficio de la salud pública, el
Derecho Fundamental a la Salud y la erradicación de la
corrupción.
En la evaluación del cumplimiento del
CONPES 155 del 30 de agosto de 2012 de Política
Farmacéutica Nacional (PFN) debe resaltarse que los avances
logrados hasta 2018 en los indicadores de resultados y
de gestión, fueron neutralizados por
el accionar de las organizaciones gremiales
farmacéuticas (AFIDRO, ASINFAR y Cámara Farmacéutica de
la ANDI)
que exigieron a la nueva administración (ver
Exigencia de medidas inmediatas firmada por el presidente de Afidro) que
fijó tres puntos "para para restaurar la confianza
entre las autoridades sanitarias y el sector privado
farmacéutico": a) Anular la apertura de la competencia
del
Decreto de Biotecnológicos, b) Bloquear la
declaratoria de interés público con fines de licencia
obligatoria solicitada por organizaciones de la sociedad
civil (para antivirales anti-Hepatitis C y otras
futruras) y c) Bloquear la fijación de precios a la
entrada de medicamentos de acuerdo con su valor
terapéutico (Circular 08 de 2018). Lo que no pudo ser
bloqueado normativamente, fue bloqueado con
inconsistencias o negligencia su ejecución, tal como
sucedió con el proyecto de
Resolución de Transparencia que alcanzó a publicarse
como
Resolución 2881 de 2018 que creó el Registro de
Transferencias de Valor entre actores del sector salud y
la industria farmacéutica y de tecnologías en salud, que
hasta la fecha no se implementa aún.
Normativamente,
la
actual política pública de “todos los recursos a las EPS”
en la práctica
completó un andamiaje legislativo que está en plena
ejecución e incluyó por ej.:
-
La
Resolución 848 del 5 de abril de 2019 para el Giro Previo de
recursos en el proceso de auditoria integral y agrupamiento de
solicitudes de recobro/cobro que modificó la
Resolución 1885 del 10 de mayo de 2018, que estableció el
procedimiento para el acceso, reporte de prescripción,
suministro, verificación, control, pago y análisis de la
información de tecnologías en salud que no son financiadas con
recursos de la UPC.;
-
El
Decreto 1333 del 25 de julio de 2019, reglamentó el Artículo
245 de la Ley 1955 de 2019, desarrollando el marco normativo
para ajustar el valor girado (y habilitó a la nación para
reconocer como deuda pública $ 2.764 millones -durante la
vigencia de 2019- para el pago de servicios y tecnologías no
financiadas con cargo a la UPC del régimen contributivo UPC-C);
-
El
Decreto 1350 del 26 de julio de 2019 -llamado de Glosa
Transversal- por el cual se reconoce como deuda pública y se
establecen disposiciones para el pago de acreencias por concepto
de los servicios y tecnologías no financiadas con recursos de la
UPC, indicados en el parágrafo tercero del artículo 237 de la
Ley 1955 de 2019 del Plan Nacional de Desarrollo;
-
El
Decreto 1683 de 2019 por el cual se modifican los artículos
2.5.2.2.1.10 y 2.5.2.3.3.6, y se adiciona el artículo
2.5.2.2.1.20 al Decreto 780 de 2016, en relación con las
condiciones de habilitación de las entidades responsables de la
operación del aseguramiento en salud, para fortalecer a las EPS
y
-
La
Ley 1955 de 2019 del Plan Nacional de Desarrollo 2018-2022
“Pacto por Colombia, Pacto por la Equidad” definió cuatro ejes
fundamentales de política pública en salud del actual gobierno:
1) Centralización de la administración del reconocimiento y pago
de servicios y tecnologías en salud no financiadas con cargo a
la UPC del régimen subsidiado en ADRES, 2) Definición de nuevos
Valores Máximos de Recobro VMR, 3) Acuerdo de Punto Final y 4)
Definición de Techos o Presupuestos Máximos, para la entrega
anticipada de recursos del antes llamado NoPOS a las EPS. Con
éstas y otras medidas -supuestamente para “garantizar el flujo
oportuno y efectivo de recursos…la transparencia en su
asignación…el financiamiento y prestación eficiente”- se montó
todo un andamiaje normativo para que las EPS gestionen y
administren prácticamente todos los recursos del sistema de
salud,
Y con el mismo discurso, el
Proyecto de Ley 10 de 2020 pretendió elevar a rango de Ley
toda la apropiación de recursos de la salud por parte de actores
con poder económico y político, alineados con la privatización y
oligopolización del aseguramiento y la prestación de servicios
de salud.
2.1.
Fue imposible
obtener el microdato de la información de recobros (hasta
hoy)
Después
de un largo litigio frente a los administradores fiduciarios
-Consorcios Fidufosyga y SAYP- y el propio Ministerio de Salud,
la FMC comprobó que la información magnética de recobros por $
8 billones pagados entre 2005 y 2010 tenían múltiples
valores absurdos, duplicados y triplicados, sin identificación
adecuada de prestaciones, con prestaciones POS recobradas como
NoPOS, etc., etc.
El año
2012,
el Ministerio de Salud aceptó dichas
inconsistencias, pero las consideró “legales”
porque “se respetó la normatividad vigente” e “inmodificables”
porque no pudo glosarlas dado que ni el Administrador fiduciario
ni el Ministerio tenían “facultades legales o contractuales
para hacerlo”. Argumentos que fueron negados por la Sala de
Casación Civil de la Corte Suprema cuando ordenó entregar
información validada de 26 principios activos seleccionados
por la FMC.
El Ministerio cumplió
parcialmente esta sentencia, entregando la
prueba piloto y los
resultados Fase I y II de
Rituximab, pero faltó completar datos de los 25
principios activos restantes y adoptar las medidas apropiadas
para perfeccionar y transparentar la información auditada o
validada de los recobros.
El 26 de
julio de 2019 en
respuesta a una petición de la Fundación IFARMA que encontró
inconsistencias iguales a las denunciadas por la FMC en la
información de recobros por tutelas de los años 2012-2018, la
ADRES esgrimió argumentos similares a los del Ministerio en
2012:
l
La información magnética de recobros corresponde a datos
diligenciados por las EPS y EOC, de acuerdo con la normatividad
vigente.
l
La normatividad vigente impide modificar inconsistencias en la
información de recobros.
l
El pago se realiza tras la verificación de los soportes
allegados y aprobación de “auditoría integral”.
l
Cuando existen diferencias con la información magnética, prima
la información de los soportes.
l
No pueden negarse estos pagos porque la Corte Constitucional
ordenó "eliminar requisitos inocuos" y no "imponer glosas
inconsistentes o infundadas".
l
La regulación del proceso de auditoría no ha exigido la
creación de una base de datos validados y
l
Las actividades de auditoría tienen “presunción de legalidad”
porque “se presumen realizadas con estricta sujeción al
principio de legalidad en el ejercicio de la función
administrativa"
En
resumen, el Ministerio de Salud, los Administradores fiduciarios
FiduFosyga y SAYP y ahora ADRES han reconocido inconsistencias
en la información magnética de recobros. Atribuyen a las EPS la
responsabilidad de dichas inconsistencias y dicen que no existen
recursos legales para corregirlas. Afirman que todos los
recobros se pagaron con base en la documentación física y la
auditoría integral (aunque nunca construyó una base de datos con
información real de lo auditado) y basa sus decisiones en el
“principio de legalidad, porque se ajustó a las normas
establecidas”. Es decir, no existe aún una base de datos
completa y fiable de los recobros ya pagados y además no existe
acceso público a la información de recobros.
Respuesta de ADRES a
IFARMA en 2019: La misma del Consorcio SAYP a la FMC en 2012

Repetición
para incrédulos: La
información magnética de recobros tiene tantas inconsistencias
graves, que la FMC y la Fundación IFARMA hablan de una
“catástrofe informática”. Para ADRES, eso fue responsabilidad de
las EPS y EOC recobrantes y nadie tiene facultades legales para
modificarlas.
Cada recobro se pagó con base en la auditoría integral de la
documentación allegada y cuando existieron inconsistencias, los
datos del medio magnético pasaron a ser “requisito inocuo”,
nada quedó en alguna base de datos y todo resultó
legal por el “principio
de legalidad en el ejercicio de la función administrativa”
dice textualmente ADRES como dijo en 2012 el Ministerio de
Salud.
2.2.
Inconsistencias y falta de transparencia afectan credibilidad de
MinSalud
El
Ministerio de Salud difundió imágenes de la importancia del
antes llamado NoPOS en los gastos del sector salud el año 2018
(ver gráfico). Puede verse claramente que dicho gasto bordea el
10 % del total, algo que resulta demasiado alto desde la
perspectiva de pérdidas por inconsistencias en las cuentas y 10%
del problema cuando se habla de soluciones estructurales
a los problemas de la salud.
Si la información
podría ser inconsistente en el 10% del gasto en salud de 2018
¿porqué sería consistente en el 90% restante?

Todas las dudas se
despejarían si la información del microdato fuese pública,
oportuna y periódicamente actualizada
Otra
imagen que el Ministerio de Salud difundió para presentar el
déficit acumulado de recobros por prestaciones NoPOS muestra la
serie de valores “recobrado” y “aprobado” de los años 2006-2018
para un “desbalance acumulado” de COP 7,42 Billones corrientes.
¿Cómo entender que, siendo mayor el valor recobrado que el
aprobado, se generen deudas por los valores “no aprobados”?
¿Cómo entender la nota de ADRES que habla de “valores radicados”
y “efectivamente pagados” sin incluir glosa? ¿Existen entonces
unos valores “radicados”, otros “aprobados y pagados” y otros
“aprobados no pagados” que se convierten en deuda y además
glosa”? ¿Y esa clasificación está en el
Manual de auditoria integral o algún
documento legal?.
Datos dudosos en el
cálculo del déficit acumulado de recobros para el Acuerdo de
Punto Final

Las que con seguridad fueron "aumentando año a año" fueron las
inconsistencias del sistema de información sin mecanismos de
transparencia. Hasta el día de hoy, aún NO fue posible
neutralizar a los poderosos grupos de
interés que se
beneficiaron y se siguen beneficiando de esta falla estructural
neurálgica del sistema de salaud.
2.3.
Inconsistencias y falta de transparencia afectaron últimas
medidas de MinSalud
La asignación de recursos en aplicación del Art.240 de la Ley
1955-PND que se implementó con las Resoluciones
205 y
206 de 17 de febrero de 2020, tuvo un cambio que pocos
percibieron, pero tiene mucha importancia cuando se trata de
inconsistencias en la información que sirvió de base: Los
valores “techo” se estimaron inicialmente con información
magnética de recobros (ver gráfico) pero eran tales sus
inconsistencias que tuvieron que eliminar el Anexo 3 de la
Resolución 205 y reemplazarlo por un cálculo actuarial, el mismo
que emplean las aseguradoras para estimar riesgos futuros.
Datos de recobros fueron reemplazados por cálculo actuarial en
Resoluciones de Techos de Recobro o Presupuestos Máximos

En conclusión,
las inconsistencia en los datos que sirvieron de base para
definir los Nuevos Valores Máximos de Recobro VMR, la asignación
de recursos del Acuerdo de Punto Final, los Techos de Recobro y
Presupuestos Máximos, así como el proyecto de Ley 10 de 2020,
abren serios interrogantes sobre la opacidad en el microdato del
manejo de los recursos del sistema de salud.
2.4. La política
pública de "todos los recursos de la salud a las EPS" ya fracasó
Los recursos del Acuerdo de Punto Final y
Techos Máximos de Recobro o Presupuestos Máximos, sí se
transfirieron y hasta se reajustaron al alza, pero -como fue
advertido- no se tradujeron en mejores resultados para el
sistema de salud
La política de pasar “todos los recursos a las
EPS” que ejecutó y ejecuta la actual administración, resultó
beneficiosa solo para las EPS y solo mientras sirvió y sirve
para la transferencia de más recursos para los actores con poder
que tienen atrapado el sistema de salud colombiano. El discurso
de beneficios inéditos para el sistema de salud, no solo fue
utópico, sino engañoso y perverso. Algunos hechos que hacían
previsible el resultado que ya se está cumpliendo fueron y son:
a) Pocas
EPS muestran indicadores adecuados de suficiencia administrativa
y financiera. Varias están en causal de liquidación
La “purga” que adelanta la SuperSalud está siendo limitada con
acciones legales. La normativa contempla recursos para aliviar
la habilitación financiera de las EPS, pero es muy débil para
frenar apropiaciones y desviaciones perversas. Lo más probable
es que los nuevos recursos no se dedicarán a mejorar servicios;
b) Los
controles de la
gestión de las EPS en el manejo de la UPC son claramente
insuficientes. Los mecanismos de transparencia no son reales
La Plataforma
MEDCOL-STAT tiene inconsistencias y los datos publicados
corresponden a 2019 (antes de la pandemia!). No existe
acceso al microdato de esta plataforma y no existe transparencia
en la definición de la UPC. El control es claramente
insuficiente y el buen desempeño de indicadores en 5 o 10 EPS no
garantiza el éxito de este modelo;
c) Pese
a los intentos de la Corte Constitucional para controlar la
práctica perversa de negaciones de atención, dicho problema
sigue sin solución
La pandemia COVID-19 hizo más evidentes las ineficiencias de las
EPS en el manejo de las atenciones de salud y el gravísimo
problema de negaciones de atención. Aunque algunas EPS
consideradas eficientes podrían mostrar indicadores favorables,
incluso en esos casos solo se contabilizan los pacientes ya
ingresados por el sistema y permanecen sin registrarse las
"negaciones del primer contacto", es decir, la obstrucción del
celador a la entrada, o el contestador automático que no
responde, o la operadora que contesta “no hay agenda”;
d) La
fragmentación de las EPS constituye un impedimento
estructural para solucionar problemas que requieren de
eficiencias de nivel estatal
Las patologías asociadas a los medicamentos
de alto costo son de baja prevalencia,
por lo cual las eficiencias en negociaciones de
precio-volumen se pierden por completo en
caso de
negociaciones fragmentadas con cada EPS. o si el
Gobierno sigue cediendo ante la fuerte presión gremial,
diplomática y política de las multinacionales farmacéuticas;
e) Las
EPS no tienen capacidad institucional, ni legal, ni
operativa para resolver problemas graves del sistema de
salud que el gobierno no resolvió
Mientras la mayor parte de los países del
mundo están pagando por las nuevas tecnologías de alto costo
a través de compras centralizadas,
negociaciones de precios basadas en valor terapéutico y
acuerdos de entrada (managed entry agreements) en manos del
estado, en Colombia hay compra centralizada solo para
antivirales Anti-Hepatitis C. El Artículo 72 del PND
2014-2018 y Decretos reglamentarios 433 y 710 de 2018 de
“definición de precios a la entrada y por valor terapéutico”
finalmente no pudieron implementarse por el cambio de
gobierno. Los acuerdos a la entrada, es decir los acuerdos
de reducción de costos y niveles crecientes de transferencia
de tecnología a cambio del acceso a nuestro mercado interno,
solo pueden hacerse a nivel estatal y nunca se hicieron. El
control de precios por referencia internacional PRI fue un
avance, pero resultó insuficiente y está
neutralizado, resultó insuficiente porque dejó
vacíos normativos que no se corrigieron y no fue
complementado con mecanismos como los acuerdos de entrada, y
está neutralizado porque persisten los abusos de
posición dominante en lo financiado con recursos del sistema
o el gasto de bolsillo de los pacientes y persisten los
precios exorbitantes de biotecnológicos, oncológicos,
tratamientos de enfermedades huérfanas y medicamentos
monopólicos;
Finalmente, como se predijo en el Boletín
BisBcm#47de2019
Sobre VMR y Techos de Recobro ¿a dónde va el sistema de
salud?
el fondo de
recursos de la salud es finito y está basado en información pasada,
por lo tanto, los Techos Máximos de Recobro-TMR o
Presupuestos Máximos-PM son vulnerables ante el aumento
de pacientes de alto costo y/o la entrada al mercado de tecnologías
con precios absurdamente elevados. Ante la insuficiencia
de la UPC y sus adiciones TMR para las EPS, se terminó
manteniendo el mecanismo de financiamiento NoPOS, hoy NoPBS-NoUPC.
La meta de la PFN de 2012 para reducir los "Gastos por
eventos no incluidos en el Plan de Beneficios" de 2,4
Billones en 2010 a 0,5 Billones en 2014 no se cumplió en
la anterior administración, pero con el actual gobierno,
más del doble de esa suma se entregó por adelantado a las
EPS, sin eliminar la fatídica suma de 2,4 Billones que
posiblemente persistirá como gasto no incluido en el Plan de
Beneficios. Veamos ejemplos de NUSINERSEN (SPINRAZA de
Biogen BIIB) para la entrega de solo
96 dosis por $ 23.847.251.328 en el último año móvil (4T20a3T21)
y de TEDUGLUTIDA (REVESTIVE de Baxalta) que en
Transacciones Primarias de 2021 reportó la venta de solo
5 tratamientos por $ 344.119.272.- (no se
reportaron aún Transacciones Secundarias entre otros
actores del sistema ni Transacciones Finales, es decir
Recobros, que seguramente tendrán costos aún superiores
para el sistema de salud).
NUSINERSEN (SPINRAZA de Biogen BIIB) reportó a SISMED
(trimestre 4° de 2020 a 3° de 2021) ventas
de solo
96 Viales por $ 23.846.251.328.-

.Vea
también:
La regulación de precios de medicamentos: insuficiente y
neutralizada. ¿Tiene alguna salida el sistema de salud
colombiano? |
Medicamentos en Proyectos de Reforma al Sistema de Salud
|
Política de transferir “Todos los recursos y problemas a las
EPS” está en marcha |
Sube y baja regulación de Precios de Medicamentos en
Colombia.
La experiencia demostró que las
Leyes que no fijan mecanismos concretos de participación
ciudadana y aseguramiento de su ejecución, simplemente no se
cumplen. Por esta razón el Proyecto de Reglamentación de la
Ley Estatutaria de Salud, debe crear esos mecanismos con
elementos -por ejemplo- de la
Ley de Transparencia y del Derecho de Acceso a la
Información Pública Nacional e incluso partes del
Proyecto de Ley 222 de 2021 (DANE) para el reporte
oportuno, creación, actualización y cualquier otra novedad
en la producción y difusión de información estadística o
registro administrativo, en salud. El CONPES 155 de
PFN fue elaborado antes de la promulgación de la LES y
obviamente la nueva PFN debe reformularse con la experiencia
acumulada a la fecha, para asegurar el cumplimiento de los
postulados de la LES y fijar mecanismos para su
perfeccionamiento continuo, de acuerdo con sus niveles de
cumplimiento.
|
3.
Propuestas: PFN
en Proyecto Ley Reglamentaria de LES 2022
3.1. Acuerdo No. 15: Política Farmacéutica en
Proyecto ANM
15.1 Se propone avanzar en la formulación y desarrollo de la
actual
Política Farmacéutica Nacional (PFN)
establecida en el CONPES Social 155 de agosto de 2012, el cual
fue formulado con anterioridad a la expedición de la Ley
Estatutaria en Salud (LES), de tal manera que, la nueva PFN
desarrolle lo instituido en el artículo 23:
“El Gobierno Nacional establecerá una Política Farmacéutica
Nacional, programática e integral en la que se identifiquen las
estrategias, prioridades, mecanismos de financiación,
adquisición, almacenamiento, producción, compra y distribución
de los insumos, tecnologías y medicamentos, así como los
mecanismos de regulación de precios de medicamentos. Esta
política estará basada en criterios de necesidad, calidad, costo
efectividad, suficiencia y oportunidad”.
Para el efecto, se propone que la PFN sea:
o Programática,
con metodología científica y objetivos a corto, mediano y largo
plazo.
o Integral,
con elementos de integración horizontal y vertical de las
tecnologías en salud.
o Estratégica,
con vocación de soberanía tecnológica y mecanismos de
transferencia.
o Priorizada,
hacia la defensa de la salud pública y el derecho fundamental a
la salud.
o Optimizada,
en todos sus procesos de adquisición y uso pertinente.
o Sostenible,
con base en la detección y eliminación de falsas innovaciones
tecnológicas, el freno a abusos de posición dominante y la
erradicación de todas las formas de corrupción.
o Sistema
Único e Integrado de Información en Salud para
garantizar trasparencia con acceso público a la información
epidemiológica y de todas las transacciones económicas.
15.2 Igualmente, el artículo 23, sobre trasparencia, define:
“Con el objetivo de mantener la transparencia en la oferta de
medicamentos necesarios para proteger el derecho fundamental a
la salud, una vez por semestre la entidad responsable de la
expedición del registro sanitario emitirá un informe de carácter
público sobre los registros otorgados a nuevos medicamentos
incluyendo la respectiva información terapéutica. Así mismo,
remitirá un listado de los registros negados y un breve resumen
de las razones que justificaron dicha determinación”.
No obstante, después de 10 años de proferido el CONPES 155, el
INVIMA aún mantiene inconsistencias graves en su base de datos
de medicamentos, como el manejo de
códigos únicos de medicamentos para los registros sanitarios
vigentes (ATC),
coincidencias de indicaciones por principio activo, data de
titularidad de registros sanitarios, oportunidad de renovaciones
y manejo de fechas de vigencia. A cinco años del Decreto de
apertura de competencia con Biotecnológicos, la plataforma de
Biológicos aún no funciona a la perfección. No muestra la
información de registros sanitarios, no completó la asignación
del
Identificador Único del Medicamento (IUM),
persiste la falta de parametrización de datos clave, etc. Y,
estas deficiencias se transmiten a otros sistemas de información
como el
Sistema de Información de Precios
de Medicamentos (SISMED)
y la herramienta tecnológica para prescripción MIPRES.
Por tanto, en cumplimiento del artículo 23 de la LES, el INVIMA
deberá adelantar políticas de mejor información y educación
sanitaria para la población, exigir mayor transferencia de
tecnología y contribuir al desarrollo de capacidades nacionales
crecientes en pro de mayor seguridad y soberanía farmacéutica.
15.3 En el parágrafo del citado artículo 23, la LES ordena:
“El
Gobierno Nacional, por intermedio del Ministerio de Salud y
Protección Social, estará a cargo de regular los precios de los
medicamentos a nivel nacional para los principios activos.
Dichos precios se determinarán con base en comparaciones
intemacionales. En todo caso no podrán superar el precio
internacional de referencia de acuerdo con la metodología que
defina el Gobierno Nacional.
Se regularán los precios de los medicamentos hasta la salida del
proveedor mayorista. El Gobierno Nacional deberá regular el
margen de distribución y comercialización cuando éste no refleje
condiciones competitivas.”
Este énfasis de la LES en la regulación de precios se debe a su
importancia para el acceso a los recursos terapéuticos para el
goce del derecho fundamental a la salud. Por tanto, para el
desarrollo de lo ordenado por la LES en este aspecto, la nueva
PFN debe ordenar al Ministerio de Salud y Protección Social que,
directamente o mediante una entidad especializada, se garantice
la transparencia, pertinencia, costo-efectividad y óptimos
resultados de todo lo financiado con recursos públicos de la
salud.
15.4 Impulsar y promover alianzas y mecanismos de producción
nacional de vacunas, de medicamentos e insumos y productos
básicos en salud.
15.5 Declarar exentos de IVA los medicamentos, insumos y
tecnologías básicas en el Sistema de Salud.
Proyectó: Comisión accidental. Oscar Andia (FMC, CMCB,
OBSERVAMED), Herman Redondo (ANM, Comité de Asuntos
Legislativos).
3.2.
Política Farmacéutica e Innovaciones Tecnológicas en Salud CSR-FMC
En Exposición de motivos Proyecto Ley
Reglamentaria LES de la CSR-FMC
https://www.sur.org.co/octavo-mandamiento-del-decalogo-de-la-reforma-a-la-salud-politica-farmaceutica-nacional/
-
Política Farmacéutica e Innovaciones Tecnológicas en Salud
(Artículos 15,16, 17 y 23 LES):
La Ley estatutaria ha sido considerada,
sobretodo, como la Ley de defensa de la autonomía de los
profesionales de la salud. En buena hora. Con el auge de las
reformas de salud basadas en el mercado, que no son otra cosa
que la adaptación de estructuras e instituciones a los intereses
comerciales, los actos de los trabajadores de salud se vieron
sometidos a diferentes tipos de presión, provenientes de los
intereses de los grupos económicos.
Las APBS (antes EPS) aplicaron diversas
modalidades de restricción en función de la reducción de gastos,
sin mayor consideración de las necesidades de los pacientes,
mientras por otro lado, la gran industria farmacéutica
consiguió, con medidas regulatorias (propiedad intelectual,
desregulación de precios, pago de medicamentos no POS) y con
prebendas, promoción y publicidad desbordantes, que el gasto en
medicamentos, especialmente aquellos novedosos y de alto costo,
creciera en forma exponencial. La causa principal de la
emergencia social en salud del 2009, fue el crecimiento
geométrico del gasto en medicamentos y tecnologías, mientras los
ingresos apenas crecían al ritmo de la inflación.
La Ley 100 había previsto unos mecanismos de
actualización de los listados de medicamentos y tecnologías
financiados con los recursos del sistema, mediante comisiones
técnicas independientes y autónomas. Sin embargo, estas
comisiones fueron sometidas a severas presiones, fueron
cooptadas y manipuladas, al punto que la CRES, creada con bombos
y platillos y cuyo carácter hubiera podido ser de utilidad para
el sistema, languideció en muy poco tiempo y desapareció sin
pena ni gloria. Fue reemplazada por el propio ministerio,
subordinando la necesaria independencia a los avatares políticos
y por el IETS, un instituto cuya supervivencia depende de la
venta de sus evaluaciones. La medicina basada en la evidencia,
que tantas promesas había traído, se fue desdibujando en los
laberintos de los procesos y procedimientos que rápidamente han
sido instrumentalizados en favor del mejor postor.
Con el TLC con los Estados Unidos, se generó en
Colombia lo que OBSERVAMED denominó “el octenio de la
des-regulación” (2002-2010) que se tradujo en altos precios para
los medicamentos. Gracias a las Organizaciones de la sociedad
civil, los colombianos descubrimos que muchos medicamentos eran
más caros en Colombia, que en países desarrollados como España,
Alemania o los Estados Unidos. Para el 2012 se iniciaron
diferentes mecanismos de control de precios basados en
referenciación internacional, que han tenido grados variables de
eficacia, pues el tiempo ha mostrado que la gran industria
multinacional tiene una gran capacidad de adaptación para
rápidamente contrarrestar las medidas gubernamentales con
diversas estrategias.
Aunque en el año 2004 se había producido el
primer documento de política farmacéutica nacional fundamentada
en el uso racional de los medicamentos, sus recomendaciones
fueron ignoradas como consecuencia de la cercanía de la
industria farmacéutica multinacional con el gobierno de
entonces. Para el año 2013 se produjo, luego de un proceso
técnico y participativo, un segundo documento de política
farmacéutica que fue elevado a la categoría de documento CONPES
y fue, en consecuencia, adoptado por el pleno del gobierno.
Esta política contemplaba diferentes frentes de
trabajo, desde la modernización del sistema de registro del
INVIMA, hasta el control de precios, pasando por la educación
continuada a los profesionales y la promoción de la industria
nacional, algo que en tiempos de pandemia, ha mostrado su
pertinencia. Pero como con el control de precios, las diferentes
medidas han sido desdibujadas y han perdido su eficacia.
La adecuada gestión de la propiedad intelectual,
sobre la que se generaron interesantes propuestas, como los
precios basados en valor para el ingreso de productos
patentados, se perdió en medio de la banalidad de una
Superintendencia enfocada en la rapidez de los trámites y la
complacencia en los indicadores. Los diferentes esfuerzos de la
sociedad civil por aplicar las flexibilidades contempladas en
los tratados internacionales, fueron objeto de deshonrosas
presiones, que fueron documentadas ante la OMPI y la ONU. La más
reciente, la solicitud de declaración de interés público para
los medicamentos para la hepatitis C, completará 6 años en
octubre, sin que el gobierno haya sido capaz de producir una
respuesta. Trámite que, en el peor de los casos, debió haberse
surtido en un plazo de 6 meses de acuerdo con la normatividad
vigente.
Para enfrentar este complejo panorama, se propone
desarrollar los artículos 15, 16, 17 y 23 de la Ley Estatutaria,
mediante las disposiciones y acciones que se mencionan a
continuación.
En primer lugar, desarrollará y actualizará
continuamente la política farmacéutica basada en el concepto de
medicamentos esenciales (componente de la atención primaria) y
en la utilización exclusiva de las denominaciones comunes
internacionales. A este respecto se dará atención especial a
contrarrestar las campañas para desacreditar los genéricos, que
promueven las multinacionales farmacéuticas tanto a pacientes
como a prescriptores.
En segundo lugar, y en un esfuerzo por dar
contenido a la Autonomía Profesional, las organizaciones
científicas, académicas y gremiales de las distintas profesiones
y disciplinas de la salud desarrollarán mecanismos de
autorregulación para la prescripción de medicamentos y
tecnologías de salud, conforme lo establecido en el artículo 16
de la ley estatutaria que establece: “Los conflictos o
discrepancias en diagnósticos y/o alternativas terapéuticas
generadas a partir de la atención, serán dirimidos por las
juntas médicas de los prestadores de servicios de salud o por
las juntas médicas de la red de prestadores de servicios de
salud, utilizando criterios de razonabilidad científica, de
acuerdo con el procedimiento que determine la ley.” Al mismo
tiempo, desarrollarán mecanismos para recuperar la educación
continuada y para minimizar las interacciones con actividades
destinadas a promocionar medicamentos y tecnologías.
En el mismo sentido y retomando lo prescrito en
la Ley 1422, la LES en el Parágrafo del Artículo 17, prohíbe
expresamente la promoción u otorgamiento de cualquier tipo de
prebendas o dádivas a profesionales y trabajadores de la salud
en el marco de su ejercicio laboral, sean estas en dinero o en
especie por parte de proveedores; empresas farmacéuticas,
productoras, distribuidoras o comercializadoras de medicamentos
o de insumos, dispositivos y/o equipos médicos o similares.
Dado que la industria farmacéutica multinacional
suele argumentar que buena parte de las actividades
promocionales que desarrolla son necesarias para dar a conocer a
los profesionales y en especial a los prescriptores los
productos nuevos, la LES incorporó en el artículo 23, una
disposición con el objetivo de mantener la transparencia en la
oferta de medicamentos necesarios para proteger el derecho
fundamental a la salud, ordenando al INVIMA que dos veces al
año, emita un informe de carácter público sobre los registros
otorgados a nuevos medicamentos incluyendo la respectiva
información terapéutica. Así́ mismo, remitirá́ un listado de los
registros negados y un breve resumen de las razones que
justificaron dicha determinación.
Adicionalmente y con el interés de recuperar el
carácter técnico y la autonomía de las evaluaciones de
tecnología, el IETS será transformado en un organismo público
independiente. El sistema de salud velará por la seguridad de
las personas sujetas a tratamientos médicos, quirúrgicos, de
rehabilitación y de paliación, y financiará los medicamentos y
demás tecnologías existentes, con utilidad y seguridad
demostradas mediante rigurosos estudios científicos
independientes, requeridos para la atención integral en salud (Art
15, LES).
La Pandemia nos ha enseñado el valor de lo que se
ha denominado la soberanía farmacéutica, no solamente para la
producción de vacunas que tan cara nos está saliendo, sino
también para enfrentar la periódica escasez de medicamentos
básicos tanto para la Covid-19 como para otras patologías que no
han cesado de ocurrir. Al respecto, se creará un sistema público
de producción y participación en cadenas de suministro, con
énfasis en transferencia de tecnología y soberanía nacional.
Una de las tragedias del sistema de seguridad
social en salud, ha sido el sistema de información y a casi 30
años de la Ley 100 no hay ninguna explicación razonable como no
sea que se debe a una intencionalidad de la dirección del
sistema. Para enfrentar esta inaceptable debilidad, habrá
sistematización total de atenciones, prescripciones y
transacciones del sistema de salud con portabilidad de historias
clínicas, conectividad universal y acceso público al micro dato.
A fin de propender por una mayor racionalidad en
el uso de tecnologías, se desarrollarán mecanismos evaluadores
de pertinencia y de resultados en salud.
La LES finalmente se ocupa de fortalecer la
Política de precios, continuando con el mecanismo de
referenciación internacional de precios. A este respecto será
necesario dotar al regulador de instrumentos que permitan
mejorar la eficacia del control de precios, habida cuenta de la
demostrada habilidad de la industria para burlar las medidas. Al
mismo tiempo, deberán retomarse las iniciativas de fijación de
precios a la entrada y del uso de las flexibilidades de la
propiedad intelectual, medidas todas destinadas a estimular el
funcionamiento de un mercado competitivo en el sector
farmacéutico.
Francisco Rossi, Fundación
IFARMA |
EN CONSTRUCCIÓN -
EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN -
EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN
|