|
|
|
El método ASPEEC
busca
contribuir al mejoramiento de políticas
públicas de alto impacto en el sistema de salud. La
serie "Venas abiertas del sistema de salud colombiano"
del
Colegio Médico de Cundinamarca y Bogotá
CMCB / FMC y
OBSERVAMED-PLUS,
mostrará
los casos más importantes,
para
✔Difundir
información científica y económica relevante sobre las tecnologías de
Mayor Impacto en el
Sistema de Salud MISS,
✔Mostrar
las inconsistencias del Sistema de Información (SISMED, MiPres,
MedColSTAT, etc.) y la Regulación de precios vigente,
✔Promover la adopción de medidas
urgentes para neutralizar "inducciones perversas"
(disposiciones vigentes que
inducen prácticas inconvenientes)
e
✔Inducir
cambios estructurales concretos que avancen hacia un nuevo
Sistema Integrado Transaccional y Distribuido de Información en
Salud SITDIS.
✔Por
una Política Pública de Manejo de Biotecnológicos.co
Evolución de Anticuerpos Monoclonales MISS 2014 a 2023
Evolución post Decreto
1782 de 2014 armi
de Apertura de la competencia de Medicamentos Biotecnológicos
Gráfico N°1: Presidente Santos firmó el Decreto de
apertura de competencia de Biotecnológicos

Anuncio del Presidente de la República Juan Manuel
Santos, rodeado del Ministro de Salud Alejandro Gaviria
y el equipo técnico-científico que culminó el diseño del
Decreto
1782 de 2014 armi
que establece los requisitos y el procedimiento para las Evaluaciones Farmacológicas
de los medicamentos biológicos en el trámite del registro
sanitario. Ver:
Página de seguimiento inicial | Boletín
de prensa MSPS | Palabras
Presidente |
Video
conferencia de prensa | Página
MinSalud seguimiento a consultas públicas | Precisiones
finales | ABC
MinSalud |
Los medicamentos de origen
biotecnológico, el futuro comienza ahora. Resumen
técnico |
Recuento
El Espectador | EE:
Abren la puerta a Biosimilares | Semana:
La sana victoria de los biotecnológicos
|
El
Tiempo Editorial: Contra viento y marea | Portafolio:
Santos da vía libre a regulación de fármacos biotecnológicos
|
Editorial El Espectador: A hacer historia.
TEMARIO:
1.
Licencia Obligatoria DOLUTEGRAVIR para uso
gubernamental
2.
Impacto DOLUTEGRAVIR GSK y Combinaciones 2014 a
2023
2.1.
Reportes de DOLUTEGRAVIR (TIVICAY® solo) a SISMED del 4°
trimestre de 2023
2.2. Ventas de DOLUTEGRAVIR (TIVICAY®GSK) solo de Trimestres
1°de 2022 a 4°de 2023
2.2.1.
Ventas reportadas por TIVICAY®GSK CUM
20071938-01 de Trim.1°2022 a 4°2023
2.2.2.
Ventas reportadas por TIVICAY®GSK CUM
20071938-02 de Trim1°2022 a 4°2023
2.3.
Impacto Lamivudina+Abacavir+DOLUTEGRAVIR (TRIUMEQ®GSK)
de 1T22 a 4T23
2.4.
Impacto Biterapia Lamivudina+DOLUTEGRAVIR (DOVATO®GSK)
de 1T22 a 4T23
2.5.
Impacto DOLUTEGRAVIR y Combinaciones de
Trimestres 1° de 2020 a 4° de 2023
2.6.
Prescripciones de DOLUTEGRAVIR y Combinaciones
en años 2021 a 2023
2.6.1.
Prescripciones DOLUTEGRAVIR y Combinaciones de
2021 a 2023 en 5 regiones
2.6.2.
Prescripciones de DOLUTEGRAVIR y Combinaciones
de 2021 a 2023 en 5 EPSs
2.7.
Importancia de DOLUTEGRAVIR y Combinaciones para
GlaxoSmithKline GSK
2.7.1.
Evolución de ventas de GlaxoSmithKline GSK en la
última década
2.7.2.
Ventas de GlaxoSmithKline GSK en el último
trimestre de 2023
3,
Presente y futuro de tratamientos del VIH-SIDA
en Colombia
3.1.
Situación del VIH-SIDA en Colombia según la
Cuenta de Alto Costo en 2022
3,2,
Informe CAC no diferencia TENOFOVIR Disoproxil
de TENOFOVIR Alafenamida
3.3.
En 10 esquemas más reportados 7 incluyen
TENOFOVIR y hay 3 opciones STR
3.4.
EMTRICITABINA + TENOFOVIR Alafenamida +
BICTEGRAVIR la opción Gilead
3.5.
BIKTARVY la opción STR de GILEAD: Monopólica y
sin regulación de precios
3.6.
Impacto de EMTRICITABINA sin BICTEGRAVIR se suma
al interés de GILEAD
4.
DOLUTEGRAVIR y moléculas para opciones no
protegidas
4.1.
Ventas de LAMIVUDINA sin DOLUTEGRAVIR durante
los años 2014 a 2023
4.2.
Ventas de TENOFOVIR DISOPROXIL (sin protección
de patente) de 2014 a 2023
4.3.
En Colombia TENOFOVIR ALAFENAMIDA tiene solo un
competidor disponible
5.
DOLUTEGRAVIR y combinaciones en opciones no
protegidas
5.1.
LAMIVUDINA + TENOFOVIR DISOPROXIL + DOLUTEGRAVIR
opción STR de OPS
5.2.
LAMIVUDINA + TENOFOVIR DISOPROXIL + DOLUTEGRAVIR
Otras Opciones STR
5.3.
Combinación LAMIVUDINA + DOLUTEGRAVIR ¿Otra opción
STR para Colombia?
6.
Proyección acciones de Litigio Estratégico sobre
VIH-SIDA
7.
Proyección de cambios estructurales en el
sistema de salud
7.1.
Acuerdo No.15 de Política Farmacéutica en
Proyecto de Reforma a la Salud ANM
7.2.
Ley 2386 de 25jul24 de SOBERANÍA FARMACÉUTICA logro de
la Sociedad Civil
7.3.
Sistema Integrado Transaccional y Distribuido de
Información en Salud SITDIS
7.4.
Enlaces de respaldo documental de DOLUTEGRAVIR y sus
combinaciones |
Después de la declaratoria de existencia de razones de
interés público para someter la patente del principio
activo Dolutegravir a licencia obligatoria en la
modalidad de uso gubernamental (mediante la
Resolución N° 01579 de 2023
armi) el 23 de abril de 2024 la
Superintendencia de Industria y Comercio SIC expidió la
histórica
Resolución No. 20049 de 2024
armi, que concedió la
Licencia Obligatoria para Uso Gubernamental (LOUG) de
DOLUTEGRAVIR, (TIVICAY®)
medida que -por primera vez- se expidió en
Colombia y ya entró en vigencia (pese a las
acciones legales interpuestas por AFIDRO
armi. y otros actores interesados.
Resumimos aquí la información más relevante
para promover tratamientos de
✔mayor eficacia,
✔menores efectos secundarios y
✔mejor
relación costo-beneficio, que sirvan al interés
de la salud pública,
independientemente de las acciones legales que se
interpongan en su contra.
Con fecha 20ago24, MinSalud
publicó el Proyecto
de Resolución armi con
su respectiva Memoria
Justificativa armi,
estableciendo un período de consulta pública hasta el Miércoles
28 de agosto de 2024, (5:00 p.m.). |
|
1.
Licencia Obligatoria DOLUTEGRAVIR para uso
gubernamental
ANUNCIO DE MINSALUD EN EL ULTIMO CONGRESO DE LA ASOCIACIÓN DE
HOSPITALES Y CLÍNICAS

Anuncio de la Licencia Obligatoria de DOLUTEGRAVIR en
el último Congreso de la Asociación de Hospitales y
Clínicas. Ver Video en 1h:11min:00
Después de la
Resolución N° 01579 de 2023
armi del 23 de abril de 2024, la
Superintendencia de Industria y Comercio SIC expidió la
Resolución No. 20049 de 2024
armi, que concedió la
Licencia Obligatoria para Uso Gubernamental (LOUG) de
DOLUTEGRAVIR, esta medida que por primera vez se expidió en
Colombia, entrará en vigencia plena cuando se resuelven las
acciones legales interpuestas por AFIDRO
armi. y otros actores
interesados. La
Resolución SIC 34716 del 28jun24
armi resolvió el recurso de
reposición presentado por los titulares de la patente
07115501A de DOLUTEGRAVIR (SHIONOGI & CO. y VIIV
HEALTHCARE CO.) y ratificó la licencia obligatoria de
uso gubernamental por razones de interés público. Con
fecha 20ago24,
MinSalud publicó el
Proyecto de Resolución
armi con su respectiva
Memoria Justificativa
armi, estableciendo un período de consulta pública hasta el
Miércoles 28 de agosto de 2024, (5:00 p.m.).
2.
Impacto DOLUTEGRAVIR GSK y Combinaciones 2014 a 2023
Según datos reportados por GlaxoSmithKline a SISMED, en solo un
par de años DOLUTEGRAVIR
(TIVICAY®)
pasó de vender miles de millones a
vender decenas de miles de millones y en 2023 pasó los $133,000
millones. En el gráfico N°1 puede verse el efecto de la
introducción de sus combinaciones con Lamivudina y Abacavir (TRIUMEQ)
y solo Lamivudina (DOVATO) que constituyen un ejemplo del efecto
de las ampliaciones de la protección de la propiedad intelectual que
implementarse en
Colombia: Las moléculas de interés para las farmacéuticas pueden
obtener una protección "express" para el mercado local, cuyo
vencimiento no interfiere la protección de sus patentes
internacionales (las cuales además pueden ser ampliadas con
mecanismos adicionales conocidos como "evergreening").
Por tal razón, tuvo que adelantarse la Declaratoria de Interés
Público (DIP) como requisito para obtener la Licencia
Obligatoria (LO) así sea solo "para uso gubernamental". En ese
contexto, veamos la evolución de las ventas reportadas a SISMED
por DOLUTEGRAVIR y sus combinaciones en los años 2014 a 2023:
Gráfico N°1: DOLUTEGRAVIR y
Combinaciones. Evolución de ventas anuales en unidades y valores de 2014
a 2023
 . .
DOLUTEGRAVIR (TIVICAY® de GLAXOSMITHKLINE) obtuvo su Registro
Sanitario en 2014 (INVIMA 2014M-001555) y la renovó en 2019 (INVIMA
2019M-0015552-R1), Inició sus reportes a SISMED el año 2015. La
combinación LAMIVUDINA + ABACAVIR + DOLUTEGRAVIR (TRIUMEQ®
de GSK) se registró en 2015 (INVIMA 2015M-0016583) y sus ventas
se reflejaron significativamente en SISMED desde 2019. La
combinación LAMIVUDINA + DOLUTEGRAVIR (DOVATO® de GSK) se
registró en 2021 (INVIMA 2021M-0020330). En 9 años, de 2015 a
2023 el acumulado de ventas de unidades diversas reportadas a
SISMED por el laboratorio superaron el millón y las ventas
en valores llegaron a $400.000 millones. La estrategia de
desarrollar mercados con combinaciones de moléculas en este caso
resulta más exitosa para la farmacéutica porque coincide con la
tendencia internacional "Single Treatment Regimen STR" que
ofrece mejores resultados terapéuticos con menos efectos
secundarios.
2.1.
Reportes de DOLUTEGRAVIR (TIVICAY®
solo) a SISMED del 4° trimestre de 2023
En
la pantalla de seguimiento por Principio Activo del
Sistema VMI-CFN
puede verse que DOLUTEGRAVIR (TIVICAY® 50 mg de GLAXOSMITHKLINE
COLOMBIA S.A.) fue incluido en Normas Farmacológicas con Código
4.1.3.0.N10. El Código ATC J05AX12 asignado en la
base de datos del INVIMA está desactualizado. El ATC actualizado
por la OMS es J05AJ03. DOLUTEGRAVIR obtuvo Protección del
Decreto 2085 (Patente Express) con vigencia del 5 de enero de
2015 al 5 de enero de 2020 (Acta 45 de 2013 numeral
3.1.1.2). Sus precios aparecen regulados en las últimas
Circulares de la Comisión Nacional de Precios de Medicamentos
CNPM y el Plan de Beneficios PBS incluye todas las
concentraciones y formas farmacéuticas.
.
Gráfico N°2: Pantalla de
seguimiento del Principio Activo DOLUTEGRAVIR correspondiente al
4° trimestre de 2023

TIVICAY 50 mg registró una presentación comercial con CUM
20071938-01 Frasco x 30 Tabletas recubiertas y con CUM
20071938-02 para muestras médicas. En el último trimestre de
2023, la presentación comercial reportó ventas de
Transacciones Primarias (del laboratorio importador) de
59.739 unidades por COP 21.651.982.950 con Precio
Promedio de la Presentación en Sismed PPPS de COP 362.443.
Los demás actores reportaron ventas de Transacciones
Secundarias de 541.575 tabletas por COP
9.198.782.968 con PPPS de COP 16.985 cada tableta.
Por Transacciones Finales (Cobros y Recobros a cargo del
Sistema) se reportaron 453.050 tabletas por COP
6.653.505.854 con PPPS de COP 14.686 cada tableta.
Entre los Cobros y Recobros pagados por el Sistema en el último
trimestre de 2023, con CUM 20071938-02 de MUESTRA MÉDICA
sin valor comercial, aparecen 250 unidades por COP
26.238.130 con PPPS de COP 104.953. Esto elevó las
Transacciones Finales a 453.300 tabletas por COP
6.679.743.984 con PPPS de COP 14.736 cada tableta.
2.2.
Impacto de DOLUTEGRAVIR (TIVICAY®GSK) de
Trimestres 1°de 2022 a 4°de 2023
Las pantallas de
seguimiento a los reportes de TIVICAY 50 mg con CUM
20071938-01 (presentación comercial) y CUM
20071938-02 (muestras médicas) desde el trimestre 1° de 2022
hasta el 4° de 2023, permiten ver el detalle de
Transacciones Primarias, reportadas por el laboratorio importador,
Transacciones
Secundarias reportadas por otros actores de la cadena de
distribución y Transacciones Finales reportadas como
Cobros y Recobros al Sistema de Salud. Llaman la atención
especialmente las cantidades en unidades y los valores absurdos
de los datos "multifuente" de transacciones secundarias de los
segundos trimestres de 2023 y 2022 de la presentación comercial,
así como el precio regulado y las transacciones secundarias y
finales de las muestras médicas "sin valor comercial".
2.2.1. Ventas
reportadas por TIVICAY®GSK CUM 20071938-01 de
Trim.1°2022 a 4°2023
La evolución de las ventas reportadas por TIVICAY 50 mg CUM
20071938-01 del trimestre 1° de 2022 al 4° de 2023
puede verse en el siguiente gráfico:
Gráfico N°3: Pantalla de
seguimiento de reportes de DOLUTEGRAVIR (TIVICAY 50 mg GSK)
CUM 20071938-01 de Trimestres 1° de 2022 a 4° de 2023
En el fragmento superior de la pantalla enmarcamos los datos
básicos de esta presentación: Régimen de la regulación de
precios que le corresponde, Registro sanitario, Nombre comercial
semiparametrizado, Principio activo parametrizado y no, Forma
farmacéutica, Concentración del principio activo, Presentación
comercial, etc. En las ventanas de la parte media en bloques
verticales se muestran el bloque de Transacciones primarias
institucional y comercial sumadas de ventas en unidades y
valores con su respectivo cálculo de Previo Promedio de la
Presentación en SISMED (PPPS) seguido de los bloques de
Transacciones solo institucionales y de solo comerciales. Y le
siguen las columnas del Factor de Cálculo de Unidosis con los
respectivos PPPS unitarios. Las líneas de fondo verde
corresponden a Transacciones primarias, las de fondo azul a
Transacciones secundarias y las de fondo blanco a Transacciones
finales. En la parte inferior, aparece la tabla comparativa de
PPPS de Transacciones primarias, secundarias y finales junto al
Precio Máximo de Venta PMV fijado por la última Circular de la
Comisión Nacional de Precios de Medicamentos CNPM y el Precio
Regulado Ajustado PRA para prestadores, con Factor de Cálculo de
Unidosis con los respectivos PPPS unitarios. Por debajo, se
encuentran la línea de Precios al Público Encuestados PPE en una
muestra de 9 plataformas de Internet y el campo memo de
anotaciones regulatorias y detalles del Registro sanitario
tomado de la base de datos del INVIMA.En los 4 segmentos de esta
pantalla se destacan los siguientes datos:
|
10 Datos
relevantes en pantalla de seguimiento
de reportes de TIVICAY 50 mg CUM 20071938-01 del
trimestre 1°de 2022 a 4°de 2023 |
|
1.2.1.1. |
TIVICAY 50 mg
CUM 20071938-01 Ya tiene una renovación del registro
sanitario como INVIMA 2019M-0015552-R1 y
permanece sometido a régimen de Control Directo
en la regulación de precios vigente. Algo irrelevante,
porque el precio regulado equivale al triple del precio
reportado por el laboratorio. |
|
1.2.1.2. |
La Protección
de datos de prueba del Decreto 2085 para DOLUTEGRAVIR
estuvo vigente hasta el 5 de enero de 2020 y
actualmente se encuentra VENCIDA. Nótese que el
vencimiento de la protección "express" del Decreto 2085
NO AFECTA la protección de patente internacional que
sigue vigente |
|
1.2.1.3. |
Actualmente
el sistema de reportes a SISMED no cuenta con mecanismos
de validación y analítica de datos, razón por la
cual pueden publicarse casos como del 2° trimestre
de 2023 con reportes increíbles de Transacciones
secundarias con 531.937.970 unidades por un valor
de COP 9.575.398.029.459.- |
|
1.2.1.4. |
La falta de
mecanismos de validación y analítica de datos en SISMED
permite que datos errados como los de Transacciones
secundarias comerciales de los trimestres 2° de 2023 y
2022 afecten los totales de Transacciones secundarias
institucionales y comerciales del trimestre y los
acumulados anuales. |
|
1.2.1.5. |
Los errores
por falta de validación y analítica de datos en
SISMED que se observaron en 2023 y 2022 afectan
básicamente los datos reportados de Transacciones
secundarias comerciales o institucionales y
Transacciones finales que son MULTIFUENTE, es decir de
múltiples actores reportantes. |
|
1.2.1.6. |
Dado que los
errores por falta de validación y analítica afectan
especialmente a Transacciones secundarias y finales que
son MULTIFUENTE, el análisis de las ventas reportadas a
SISMED debe basarse en datos de Transacciones
primarias del Laboratorio productor o importador que
son MONOFUENTE. |
|
1.2.1.7. |
Al comparar
los Precios PPPS de Transacciones primarias, secundarias
y finales puede verse que los precios del Laboratorio
son de cajas por 30 tabletas mientras los de
Transacciones secundarias y finales son por tableta.
El precio por caja de 30 pagado por el Sistema
aparese en los campos amarillos. |
|
1.2.1.8. |
Los precios
regulados, el máximo de venta y ajustado para
prestadores (en fondo rojo) más que triplican los
precios reportados por el Laboratorio, los actores de la
cadena de distribución y los pagados por el Sistema de
salud. Los cambios del 31jul24 no corrigen estos
errores, antes los empeoran. |
|
1.2.1.9. |
Simplificando
estos datos puede decirse que los precios regulados
de cada tableta de TIVICAY ($52.506 y $54.343) más que
triplican el precio reportado por el Laboratorio y
pagado por el Sistema de salud. Los precios
regulados publicados el 31/julio/2024 no corrigen el
problema, antes lo empeoran. |
|
1.2.1.10. |
El Precio
Público Promedio Encuestado PPPE en 5 plataformas de
Internet el 2° trimestre de 2024 fue $725.487
caja de 30 tabletas ($24.183 cada tableta). Por
lo tanto, los precios regulados de TIVICAY 50 mg de
GlaxoSmithKline más que duplican los precios de venta al
público. |
|
En
síntesis, frente el impacto notable de DOLUTEGRAVIR (TIVICAY 50 mg
CUM 20071938-01) en las finanzas del sistema de salud
colombiano de de los años 2022 y 2023 se observó una
debilidad institucional traducida en prácticas
de protección a la propiedad intelectual de las
multinacionales farmacéuticas. Dichas prácticas dañaron
el sistema de información e inutilizaron la regulación de precios durante la
administración Duque-Ruiz (por falta de validación y
analítica de los datos reportados s SISMED) algo que aún
no se corrigió durante la actual administración, pese a
los esfuerzos iniciales de este gobierno.
|
2.2.2. Ventas
reportadas por TIVICAY®GSK CUM 20071938-02 de
Trim1°2022 a 4°2023
Las ventas reportadas por TIVICAY 50 mg CUM
20071938-02 de "muestras médicas sin valor comercial" entre el 4° trimestre de 2021
y 4° trimestre de 2023 permite ver Transacciones secundarias (de
múltiples actores de la cadena de distribución) por $343.784.997
el año 2023, junto con otras inconsistencias que pueden verse en
el siguiente gráfico:
Gráfico N°4: Pantalla de
seguimiento de reportes de DOLUTEGRAVIR (TIVICAY 50 mg GSK)
CUM 20071938-02 de Trimestres 1° de 2022 a 4° de 2023
|
7
inconsistencias en los reportes de TIVICAY 50 mg CUM 20071938-02 MUESTRA MEDICA de
trimestres 1° de 2022 a 4° de 2023 |
|
1.2.2.1. |
TIVICAY 50 mg
CUM 20071938-02 Muestra Médica sin valor comercial,
se encuentra erróneamente sometida a régimen de Control
Directo. No debería fijarse precio regulado
para algo no vendible. Este error genera una "inducción
perversa" que daña el sistema de regulación de precios
vigente en el país. |
|
1.2.2.2. |
Como el
sistema de reportes a SISMED no cuenta con mecanismos
de validación y analítica de datos, no detecta ni
corrige datos como del 2° trimestre de 2023 con reportes
de Transacciones finales (cobros y recobros)) de
200 unidades sin valor comercial que el sistema
pagó por COP 26.238.130. |
|
1.2.2.3. |
Dado que el
sistema de reportes a SISMED no valida ni analíza datos,
tampoco detectó ni corrigió datos como del trimestre 1°
de 2023 con Transacciones secundarias (reportados por
actores de la cadena de distribución) con 19.020
unidades de muestras médicas sin valor comercial por COP
342.360.000. |
|
1.2.2.4. |
Según datos
acumulados de Transacciones secundarias institucionales
y comerciales de 2023 se negociaron 19.023 tabletas
del CUM 20071938-02 de muestras médicas
sin valor comercial por COP 343.784.997 y se habrían
cobrado o recobrado al sistema 430 tabletas
por COP 33.909.670 a 78.860 c/u. |
|
1.2.2.5. |
Según datos
acumulados de Transacciones secundarias institucionales
y comerciales de 2022 se negociaron 480 tabletas
del CUM 20071938-02 de muestras médicas
sin valor comercial por COP 17.061.830 y se habrían
cobrado o recobrado al sistema 210 tabletas
por COP 8.799.870 a 41.904 c/u. |
|
1.2.2.6. |
Si el precio
reportado de COP 104.953 en Transacciones finales
corresponde a una tableta, la presentación comercial de
30 tabletas (CUM 20071938-02) se habría
cobrado o recobrado al sistema por COP 3.148.576,
es decir, casi al doble del precio regulado, que a su
vez triplica el precio del Laboratorio. |
|
1.2.2.7. |
La nueva
lista de precios regulados -publicada el 31 de julio de
2024- no corrige estos problemas.
En lugar de ajustar los cálculos a la realidad del país
aumenta el precio regulado en COP 117.629,
pasando el precio regulado de la muestra médica sin
valor comercial de COP 1.457.536 a COP 1.575.165.
|
|
En
síntesis, tal como se observa en el caso de DOLUTEGRAVIR
(TIVICAY 50 mg
CUM 20071938-02 de "muestra médica sin valor comercial")
la debilidad institucional también se traduce en la
misma normatividad que genera inconsistencias que
deterioran la calidad de los datos del sistema de
información. Fijar precios regulados a muestras médicas
sin valor comercial es un contrasentido que indujo e
induce a la existencia de reportes de transacciones que
pueden ser fraudulentas. Y la falta de validación y analítica
de los datos reportados s SISMED, deteriora cada vez más
el sistema de información. |
2.3.
Impacto Lamivudina+Abacavir+DOLUTEGRAVIR (TRIUMEQ®GSK) de
1T22
a 4T23
El Impacto de la
combinación Lamivudina + Abacavir + DOLUTEGRAVIR (TRIUMEQ®GSK
CUM 20081132-01) en los reportes a SISMED del trimestre 1° de 2022 al 4° de 2023
puede verse en el siguiente gráfico:
Gráfico N°5: Pantalla de
seguimiento de TRIUMEQ GSK CUM 20081132-01 de Trimestres 1° de
2022 a 4° de 2023

|
En
síntesis, las mismas inconsistencias mencionadas en el
caso de DOLUTEGRAVIR (TIVICAY 50 mg
CUM 20071938-01) se reproducen
con los reportes de TRIUMEQ CUM 20081132-01 del trimestre
1°de 2022 a 4°de 2023 y múltiples casos donde se observan las mismas
manifestaciones de debilidad institucional que se
traducen en prácticas que favorecen la protección a la propiedad intelectual de las
farmacéuticas, inutilizan la regulación de
precios y dañaron -y siguen dañando- el sistema de información,
sin que el gobierno actual haya logrado aún revertir los
daños que vienen de la administración Duque-Ruiz. |
2.4.
Impacto Biterapia Lamivudina+DOLUTEGRAVIR (DOVATO®GSK)
de 1T22
a 4T23
El Impacto de la
combinación Lamivudina + DOLUTEGRAVIR (DOVATO GSK CUM
20171830-01) en los reportes a SISMED del trimestre 1° de 2022 al 4° de 2023
puede verse en el siguiente gráfico:
Gráfico N°6: Pantalla de
seguimiento de DOVATO GSK CUM 20171830-01 de Trimestres 1° de 2022 a 4°
de 2023

|
En
síntesis, todo lo mencionado en los casos de
DOLUTEGRAVIR (TIVICAY 50 mg
CUM 20071938-01 y TRIUMEQ CUM 20081132-01) del trimestre
1°de 2022 a 4°de 2023 se reprodujo con DOVATO CUM
20171830-01, con el agravante de la FALTA DE REGULACIÓN
DE PRECIOS para este último producto. |
2.5. Impacto DOLUTEGRAVIR y Combinaciones de
Trimestres 1° de 2020 a 4° de 2023
El
análisis de los reportes trimestrales a SISMED durante la
vigencia de la
Circular 06 de 2018 que
cambió sistema de reportes
(fue publicado en el Diario Oficial No. 50.677 del 6 de agosto
del 2018 e implementado a partir del 4° trimestre de 2019)
muestra que el crecimiento de ventas en
unidades y valores de la molécula DOLUTEGRAVIR (TIVICAY®)
y su Combinación con LAMIVUDINA y ABACAVIR (TRIUMEQ®).fue
igualmente dinámico. El ingreso de la
Combinación LAMIVUDINA + DOLUTEGRAVIR (DOVATO®)
en el trimestre 4° de 2021 acentuó claramente esa tendencia, tal
como puede verse en el siguiente gráfico:
Gráfico N°7: DOLUTEGRAVIR y
Combinaciones. Evolución de ventas trimestrales en unidades y
valores de Trimestres 1° de 2020 a 4° de 2023
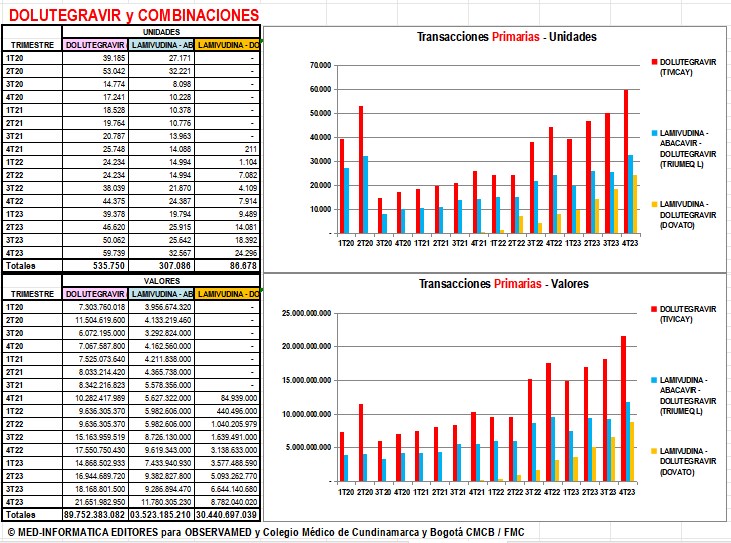
|
En
síntesis, el análisis detallado de los reportes a SISMED
de los trimestres 1° de 2020 a 4° de 2023 ratifica todo
lo mencionado en los gráficos 2, 3, 4, 5 y 6, tanto de
DOLUTEGRAVIR TIVICAY
CUM 20071938-01 como de sus combinaciones TRIUMEQ CUM 20081132-01
y DOVATO CUM 20171830-01. |
2.6. Prescripciones
de DOLUTEGRAVIR y Combinaciones en años 2021 a 2023
El análisis de las
prescripciones de DOLUTEGRAVR y sus combinaciones en la
plataforma MiPres también muestra inconsistencias prominentes
que invalidan cualquier evaluación con las modalidades que
permitía la misma. Mostramos aquí lo poco que puede verse para 5
regiones y 5 EPSs más importantes :
2.6.1. Prescripciones DOLUTEGRAVIR y Combinaciones de 2021 a 2023 en 5 regiones
El análisis de las
prescripciones de DOLUTEGRAVR y sus combinaciones en la
plataforma MiPres muestra que de 2021 a 2023 el mayor número de
prescripciones se habría generado en las regiones de Bogotá,
Santander, Valle del Cauca, Cundinamarca y Santa Marta.
Gráfico N°8. Prescripciones de
DOLUTEGRAVIR y Combinaciones de 2021 a 2023 en 5 regiones

El problema está en que el número de prescripciones
reportadas por regiones es mínimo y las cifras resultan tan
insignificantes que no alcanzan ni siquiera para configurar una
muestra mínimamente significativa.
2.6.2.
Prescripciones
de DOLUTEGRAVIR y Combinaciones de 2021 a 2023 en 5 EPSs
El análisis de las
prescripciones de DOLUTEGRAVR y sus combinaciones en la
plataforma MiPres muestra que de 2021 a 2023 el mayor número de
prescripciones se habría generado en las 5 EPSs más importantes
muestra a Compensar, Nueva EPS, Sánitas, EPS Sura y Salud Mía.
Gráfico N°9. Prescripciones de
DOLUTEGRAVIR y Combinaciones de 2021 a 2023 en 5 EPSs

El problema está en que el número de prescripciones
reportadas por EPSs es mínimo y las cifras resultan tan
insignificantes que no alcanzan ni siquiera para configurar una
muestra mínimamente significativa.
|
En
síntesis, el análisis de las prescripciones de
DOLUTEGRAVIR y sus combinaciones en los años 2021 a 2023
tanto por 5 principales regiones como por 5 principales
EPSs muestra que el número de prescripciones reportadas
por regiones y por EPSs es mínimo y las cifras resultan
tan insignificantes que no alcanzan ni siquiera para
configurar una muestra representativa. |
2.7. Importancia de DOLUTEGRAVIR y Combinaciones para GlaxoSmithKline GSK
Finalmente, es
interesante conocer la importancia de DOLUTEGRAVIR y sus
Combinaciones para GlaxoSmithKline en Colombia, algo que
permitiría estimar el nivel de recursos que empleará para
defender esta patente. Para tal fin, mostramos las ventas de
esta multinacional farmacéutica en los años 2014 a 2023 y los
totales de ventas reportadas por esta firma en el último
trimestre de 2023.
2.7.1. Evolución de
ventas de GlaxoSmithKline GSK en la última década
La evolución de las
ventas de GlaxoSmithKline en Colombia, de acuerdo con sus
reportes a SISMED de los años 2014 a 2023, puede considerarse
estable en unidades y creciente en valores hasta el año 2021,
después del cual se produce un salto de las ventas que se
revierte en unidades y se mantiene en valores. Vistos lo hechos
que se mencionaron en los puntos 2.2. a 2.5. este fenómeno puede
deberse mayormente a la influencia de DOLUTEGRAVIR y sus
Combinaciones.
Gráfico N°10. Importancia de
DOLUTEGRAVIR y sus Combinaciones para GlaxoSmithKline en
Colombia

2.7.2. Ventas de GlaxoSmithKline GSK en el último trimestre de 2023
Tal como puede verse en el Gráfico
N°10 DOLUTEGRAVIR y sus Combinaciones extremadamente Importantes
para GlaxoSmithKline en Colombia. Según reportes a SISMED del
4°trimestre de 2023, 3 de las 5 presentaciones más vendidas en
valores corresponden a DOLUTEGRAVIR TIVICAY CUM 20071938-01 y
sus combinaciones TRIUMEQ CUM 20081132-01 y DOVATO CUM
20171830-01.
Gráfico N°10. Importancia de
DOLUTEGRAVIR y sus Combinaciones para GlaxoSmithKline en
Colombia según reportes del 4°trimestre de 2023

|
En
síntesis, según los reportes de GlaxoSmithKline a SISMED,
3 de las 5 presentaciones más vendidas de esta firma en
Colombia, corresponden a DOLUTEGRAVIR TIVICAY
CUM 20071938-01 y sus combinaciones TRIUMEQ CUM 20081132-01
y DOVATO CUM 20171830-01. Esto muestra la importancia
vital de estos productos para el conglomerado comercial
GSK, que seguramente recurrirá a todos los recursos
disponibles para revertir la Licencia Obligatoria. |
3.
Presente y futuro de tratamientos del VIH-SIDA en Colombia
Desde la perspectiva de la evidencia internacional el énfasis en
DOLUTEGRAVIR de la política del actual gobierno resulta
pertinente, pero desde la perspectiva de la realidad nacional
ese sesgo puede no ser lo única única opción pertinente, tal
como puede verse en los hechos que se describen a continuación.
3.1.
Situación del VIH-SIDA
en Colombia según la Cuenta de Alto Costo en 2022
De acuerdo con el documento
Situación del VIH en Colombia 2022 de la Cuenta de Alto
Costo se resume de la siguiente manera:
Gráfico N°11: Resumen que se
muestra en la página 71 del informe "Situación del VIH en
Colombia 2022" de la Cuenta de Alto costo

En el periodo comprendido entre el 1º de febrero de 2021
y el 31
de enero de 2022, de las personas viviendo con VIH con
tratamiento antirretroviral, el 78,12% presentó una carga viral
menor de 50 copias/mL y en el 87,60% fue menor a 1.000 copias/mL.
La cobertura de
tratamiento antirretroviral en las PVV fue del 88,35 %
presentando una disminución del
3,46% con respecto al periodo anterior. La región Caribe tuvo la
mayor cobertura con un 90,33% de personas recibiendo TAR. Se
presentó mayor cobertura de terapia antirretroviral en el
régimen de excepción (89,59%), seguido por el contributivo
(89,32%). Ver más detalles en el Gráfico N°11.
3.2.
Informe CAC no diferencia TENOFOVIR
Disoproxil
de TENOFOVIR
Alafenamida
En la Tabla 28 del informe
Situación del VIH en Colombia 2022
de la Cuenta de Alto costo, el TENOFOVIR aparece como el
medicamento más reportado en las PVV Colombia 2022. No se
precisa cuánto corresponde a TENOFOVIR ALAFENAMIDA o TENOFOVIR DISOPROXIL
Fumarato, pese a que esta diferencia no es menor
Gráfico N°12: El informe "Situación del VIH en
Colombia 2022" muestra TENOFOVIR como el medicamento más
reportado en las PVV

En
esta tabla puede verse que TENOFOVIR es la molécula más
importante entre los medicamentos reportados en las PVV,
Colombia 2022, pero no se aclara cuánto corresponde a Tenofovir
solo, Trnofovir Alafenamida (con protección de patente vigente
en 2022) o Tenofovir Disoproxil fumarato (sin protección de
patente)
3.3.
En 10 esquemas más reportados 7 incluyen
TENOFOVIR y hay 3 opciones
STR
En la Tabla 29 del informe
Situación del VIH en Colombia 2022
de la Cuenta de Alto costo, el TENOFOVIR aparece en 7 de los 10
esquemas de tratamiento antirretroviral reportados con mayor
frecuencia en las PVV incidentes más importantes, sin
diferenciar si corresponden a TENOFOVIR ALAFENAMIDA (con patente
vigente en 2022) o TENOFOVIR DISOPROXIL Fumarato (sin patente vigente).
Y en este grupo aparecen 3 opciones disponibles como esquema STR,
tal como puede verse en el Gráfico N°13.
Gráfico N°13: El informe "Situación del VIH en
Colombia 2022" muestra TENOFOVIR como la combinación varíable más reportada en las PVV
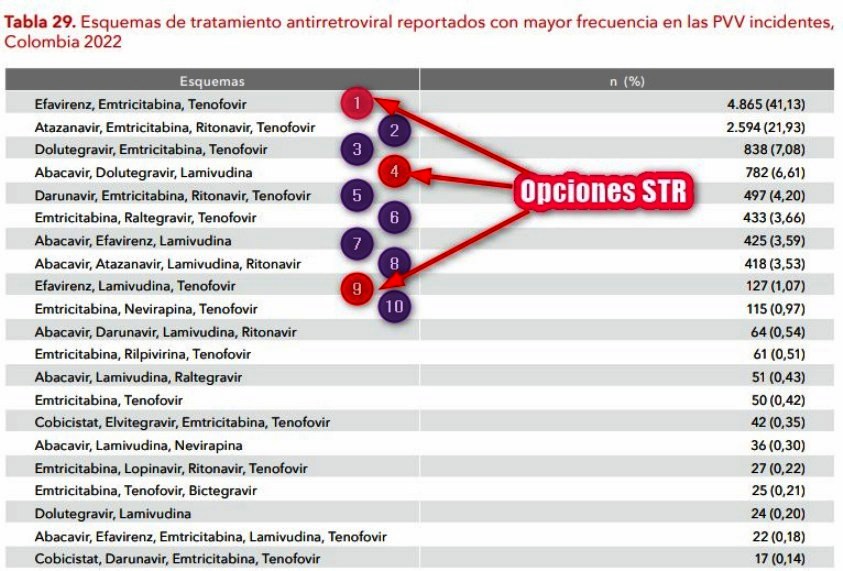
En esta
imagen, de 21 esquemas
de tratamiento antirretroviral
reportados con mayor frecuencia en las PVV incidentes
Colombia 2022, 14 incluyen
TENOFOVIR, sin que se sepa si
corresponden a TENOFOVIR ALAFENAMIDA (con patente
vigente en 2022) o TENOFOVIR DISOPROXIL Fumarato (sin patente vigente)
3.4.
EMTRICITABINA + TENOFOVIR
Alafenamida + BICTEGRAVIR la opción
Gilead
La pantalla de búsqueda de principios activos del Sistema VMI-CFN
muestra 4 opciones de combinación de EMTRICITABINA con TENOFOVIR
ALAFENAMIDA. todas con productos de Gilead (casi todas
monopólicas) mientras las combinaciones con TENOFOVIR DISOPROXIL
son múltiples y además con moléculas distintas de la opción
EMTRICITABINA. La opción de Combinación EMTRICITABINA +
TENOFOVIR ALAFENAMIDA + BICTEGRAVIR es la competidora directa de
DOLUTEGRAVIR y sus combinaciones. Las multinacionales
propietarias de DOLUTEGRAVIR entablaron y ganaron el litigio
internacional llegando a un arreglo económico que está
vigente.
Gráfico N°14: La Combinación EMTRICITABINA + TENOFOVIR ALAFENAMIDA + BICTEGRAVIR
es la opción Gilead competidora de Dolutegravir
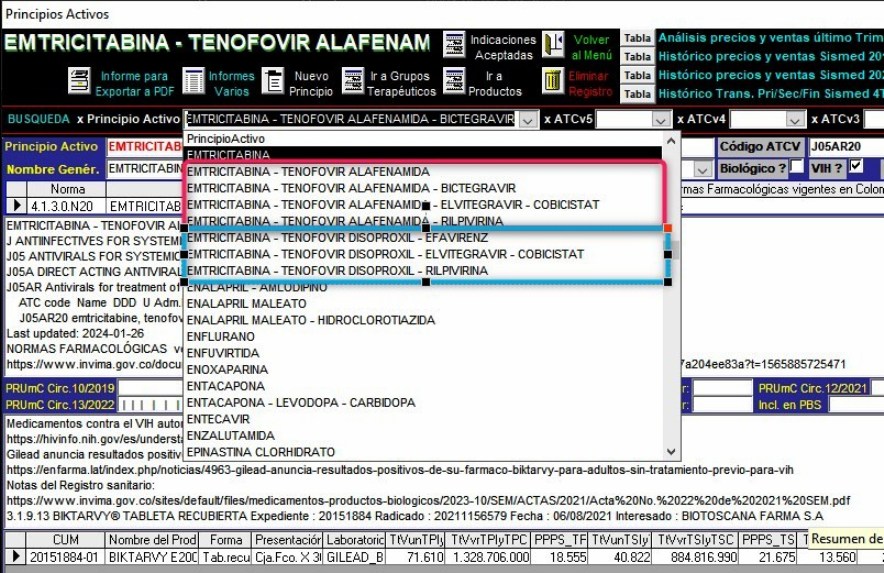
Aunque
el volumen de ventas de BIKTARVY no es aún muy significativo, el
análisis de las mismas variables analizadas con DOLUTEGRAVIR
permiten deducir que el impacto de las opciones de Gilead
terminará siendo superior.
3.5.
BIKTARVY la opción
STR de GILEAD: Monopólica y sin regulación de
precios
Las pantallas de seguimiento de principios
activos y presentaciones reportadas a SISMED de BICTEGRAVIR y
BIKTARVY muestran casi las mismas características e
inconsistencias observadas con DOLUTEGRAVIR, tal como puede
verse en los siguientes gráficos..
Gráfico N°15: La Combinación EMTRICITABINA + TENOFOVIR ALAFENAMIDA + BICTEGRAVIR
de Gilead es monopólica y no tiene regulación de precios

|
En
síntesis, la Combinación EMTRICITABINA + TENOFOVIR
ALAFENAMIDA + BICTEGRAVIR (BIKTARVY®
de GILEAD) es también monopólica, muestra inconsistencias
similares a las descritas con DOLUTEGRAVIR en sus
reportes a SISMED que no se validan ni analizan.
Evidencia también una debilidad institucional que se
traduce en una normatividad que favorece las prácticas
de protección a la propiedad intelectual de las
multinacionales farmacéuticas. En este caso con el
agravante de ni siquiera haberse incluido en la
regulación de precios. |
3.5.1. Prescripciones de
BIKTARVY
de 2021 a 2023 en 5 Regiones
El análisis de las
prescripciones de la Combinación EMTRICITABINA + TENOFOVIR
ALAFENAMIDA + BICTEGRAVIR (BIKTARVY® de GILEAD) en la plataforma
MiPres también muestra inconsistencias prominentes que invalidan
cualquier evaluación con las modalidades que permitía la misma.
Mostramos aquí lo poco que puede verse para 5 regiones y 5 EPSs
más importantes
Gráfico N°16. Prescripciones de
BIKTARVY® de GILEAD de 2021 a 2023 en 5 Regiones

El análisis de las prescripciones de
BIKTARVY® de GILEAD en la plataforma MiPres muestra que de 2021
a 2023 el mayor número de prescripciones se habría generado en
las regiones de Bogotá, Valle del Cauca, Antioquia, Cundinamarca
y Santander..El problema está en que el número de prescripciones
reportadas por regiones es mínimo y las cifras resultan tan
insignificantes que no alcanzan ni siquiera para configurar una
muestra mínimamente significativa.
3.5.2. Prescripciones de
BIKTARVY
de 2021 a 2023 en 5 EPSs
El análisis de las
prescripciones de BIKTARVY® de GILEAD en la plataforma MiPres
muestra que de 2021 a 2023 el mayor número de prescripciones se
habría generado en las 5 EPSs más importantes muestra a Sánitas,
Nueva EPS, EPS Sura, Compensar y Famisanar.
Gráfico N°17. Prescripciones de
BIKTARVY® de GILEAD de 2021 a 2023 en 5 EPSs

El problema está en que el número
de prescripciones reportadas por EPSs es mínimo y las cifras
resultan tan insignificantes que no alcanzan ni siquiera para
configurar una muestra mínimamente significativa.
|
En
síntesis, el análisis de las prescripciones de la
Combinación EMTRICITABINA + TENOFOVIR ALAFENAMIDA +
BICTEGRAVIR (BIKTARVY®
de GILEAD) en los años 2021 a 2023 tanto por 5 principales
regiones como por 5 principales EPSs muestra que el
número de prescripciones reportadas por regiones y por
EPSs es mínimo y las cifras resultan tan insignificantes
que no alcanzan ni siquiera para configurar una muestra
representativa. |
3.6. Impacto de
EMTRICITABINA sin BICTEGRAVIR se suma al interés de GILEAD
Si asumimos el
hecho de la existencia de una confrontación mundial de
multinacionales farmacéuticas por este mercado, es importante
observar que -tal como puede verse en el Gráfico N°18- en
Colombia, el dinamismo de EMTRICITABINA es evidente. Si a este
hecho se suma la dinámica de TENOFOVIR ALAFENAMIDA y la
exclusividad de BICTEGRAVIR, puede concluirse que existe una
realidad de mercado que contradice la exclusividad de la
política pública que se está adelantando con DOLUTEGRAVIR y
plantea la necesidad de buscar soluciones más ajustadas a la
realidad nacional e internacional.
Gráfico N°18. Ventas de
EMTRICITABINAS sin BITEGRAVIR en Colombia - Años 2014 a 2023

|
En
síntesis, si tomamos en cuenta la evolución de la
Combinación EMTRICITABINA + TENOFOVIR ALAFENAMIDA +
BICTEGRAVIR (BIKTARVY®
de GILEAD) a nivel nacional e internacional, y la
evolución de sus componentes EMTRICITABINA, TENOFOVIR
ALAFENAMIDA y BICTEGRAVIR en forma independiente,
debemos concluir que, en el país, la política pública
basada en DOLUTEGRAVIR debe complementarse con
alternativas vigentes en la realidad nacional. |
4.
DOLUTEGRAVIR y moléculas para opciones no protegidas
La Licencia
Obligatoria de
DOLUTEGRAVIR para uso gubernamental, está en el núcleo de
una política pública ajustada a la
tendencia mundial de
Tratamientos de dosis diaria STR,
que se consideran de
✔mayor eficacia,
✔menores efectos secundarios y
✔mejor
relación costo-beneficio. Según el
Proyecto de Resolución
armi con su respectiva
Memoria Justificativa
armi esta política se implementará con DOLUTEGRAVIR
y sus
combinaciones con
LAMIVUDINA y TENOFOVIR DISOPROXIL Fumarato.
4.1.
Ventas de LAMIVUDINA sin DOLUTEGRAVIR durante los años 2014 a
2023
El Gráfico N°19 muestra la evolución de las ventas de LAMIVUDINA
sin DOLUTEGRAVIR en la última década. Puede verse que luego de
una evolución dinámica de sus ventas en unidades y valores hasta
el año 2016, se produjo una caída constante hasta el año 2023,
mucho más manifiesta en unidades que en valores.
Gráfico N°19. Ventas de
LAMIVUDINA sin DOLUTEGRAVIR en Colombia - Años 2014 a 2023

4.2.
Ventas de TENOFOVIR DISOPROXIL (sin protección de patente) de
2014 a 2023
El Gráfico N°20 muestra la evolución de las ventas de TENOFOVIR
DISOPROXIL sin DOLUTEGRAVIR en la última década. Puede verse que
luego de una evolución dinámica de sus ventas en unidades y
valores hasta el año 2020, se produjo una caída extraordinaria
el año 2021 y una recuperación muy dinámica hasta el año 2023,
La caída del 2021 fue más manifiesta en unidades que en valores
y es posible que se hayan añadido inconsistencias en los
reportes.
Gráfico N°20. Ventas de TENOFOVIR
DISOPROXIL en Colombia - Años 2014 a 2023

4.3.
En Colombia TENOFOVIR ALAFENAMIDA tiene solo un competidor
disponible
Tal como puede verse en el Gráfico N°21 la Combinación
EMTRICITABINA + TENOFOVIR ALAFENAMIDA de DESCOVY CUM 20131470-01
de GILEAD, está disponible también como VYVALTO CUM 20148969-01
de Laboratorios RICHMOND de Colombia.
Gráfico N°21. Reportes trimestrales de VYVALTO CUM
20148969-01 de Laboratorios RICHMOND de Colombia - Años 2022 a 2023

Como sucede con muchos reportes a SISMED, los datos de
VYVALTO CUM 20148969-01 de Laboratorios RICHMOND también tienen
inconsistencias tales como:
a) Al igual que DESCOVY CUM 20131470-01 de GILEAD está en
régimen de Libertad de precios (es decir, no tiene precio
regulado),
b) Sus reportes de Transacciones Primarias, Secundarias y
Finales no guardan coherencia (las diferencias resultan
realmente excesivas),
c) Todos sus Precios reportados son por Tableta o UniDosis y no
por CUM. Esto hace necesario recalcular el PPPS para poder
comparar con el precio en Farmacias,
d) Obviamente, los datos reportados no están validados ni
analizados, algo que deteriora mucho la calidad de la
información.
5. DOLUTEGRAVIR
y combinaciones en
opciones no protegidas
De acuerdo con el
Proyecto de Resolución
armi con su respectiva
Memoria Justificativa
armi la opción elegida será la de la Organización
Panamericana de la Salud:
5.1.
LAMIVUDINA + TENOFOVIR DISOPROXIL + DOLUTEGRAVIR opción
STR de OPS
El Gráfico N°21
muestra una captura de la pantalla de la Combinación LAMIVUDINA+TENOFOVIR DISOPROXIL+DOLUTEGRAVIR
en la páginas de la OPS sobre el tema
Gráfico N°22: La Combinación LAMIVUDINA + TENOFOVIR DISOPROXIL + DOLUTEGRAVIR
ea la opción
elegida por la OPS

5.2. LAMIVUDINA +
TENOFOVIR DISOPROXIL + DOLUTEGRAVIR Otras
Opciones
STR
El Gráfico N°23
muestra otras opciones de suministro de la Combinación LAMIVUDINA+TENOFOVIR DISOPROXIL+DOLUTEGRAVIR
que podrían estar disponibles
Gráfico N°23: Otras opciones de
la Combinación LAMIVUDINA + TENOFOVIR DISOPROXIL + DOLUTEGRAVIR
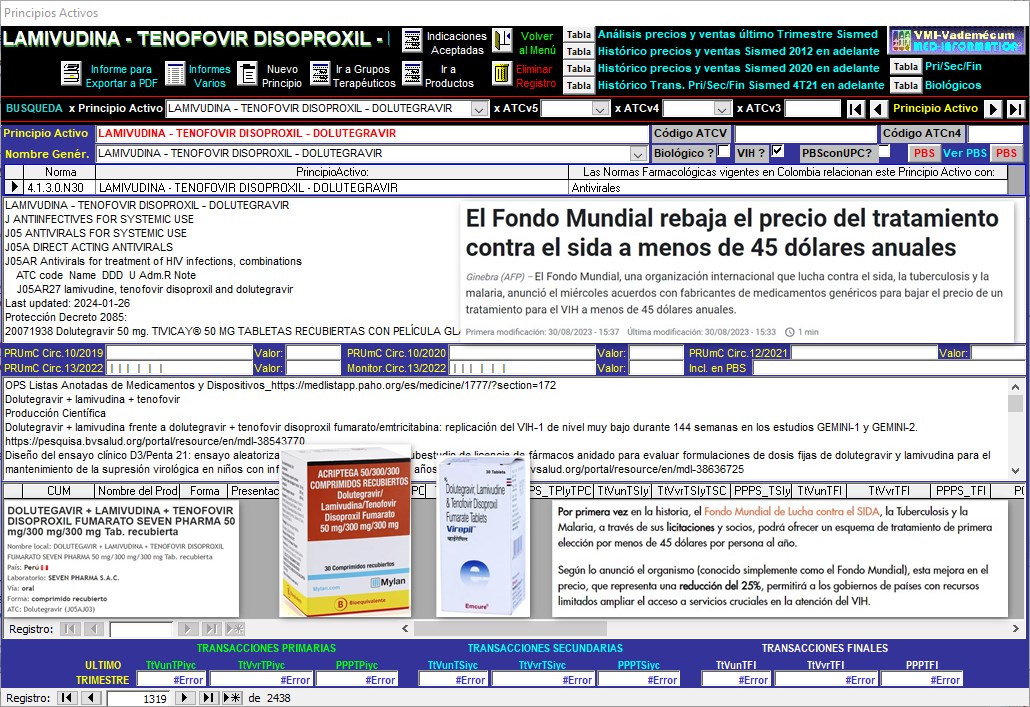
Las licencias obligatorias en curso fueron solicitadas por:
1. MINISTRO DE SALUD Y PROTECCIÓN SOCIAL 2. LABORATORIOS
RICHMOND COLOMBIA S.A.S y 3. HETERO LABS LIMITED y SEVEN PHARMA
COLOMBIA S.A.S. Otras dos fueron negadas por extemporáneas: 1.
PHARMA COLOMBIA S.A.S. y 2. EXELTIS COLOMBIA SAS
5.3.
Combinación LAMIVUDINA + DOLUTEGRAVIR ¿Otra opción
STR
para Colombia?
Existe también
suficiente evidencia internacional para el uso de la Combinación
LAMIVUDINA + DOLUTEGRAVIR, por tratarse de tratamientos
STR con
✔mayor eficacia,
✔menores efectos secundarios y
✔mejor
relación costo-beneficio, tal como puede verse en esta
presentación del Dr. Boris Revollo B. MD, PhD (Germans Trias i
Pujol University Hospital Infectious Diseases Department). Ver
Archivo convertido a PDF.
Gráfico N°24: Presentación de evidencia internacional del
uso de
la Combinación LAMIVUDINA + DOLUTEGRAVIR

Ver Actualización de las directrices 1 DTG/3TG en personas
“especiales” con VIH-1 que no han recibido tratamiento |
Informes de RWD sobre la eficacia de DTG/3TG en personas con
VIH-1 que no han recibido tratamiento y con baja carga viral
TCD4+ o alta | Nuevos datos sobre estrategias de cambio de
tratamiento | Conclusiones
|
6.
Proyección acciones de Litigio Estratégico
sobre VIH-SIDA
Tomando en cuenta que los hechos planteados en este documento
constituyen INDUCCIONES PERVERSAS que generan insuficiencias e
inconsistencias graves en el funcionamiento del sistema de salud
colombiano, es necesario adelantar urgentemente correctivos que
no requieren cambios normativos y pueden adelantarse al margen
de la aprobación de una reforma estructural. Para este fin, son
necesarios correctivos inmediatos en el sistema de información
que no pueden adelantarse sin conocer datos elementales del
sistema vigente. Por esta razón, iniciaremos acciones de litigio
estratégico, presentando Derechos de Petición dirigidos a:
✔ADRES,
sobre microdato de valores pagados por Régimen, CUM, Región,
EPS, IPS, Operador Farmacéutico y posibles estudios de
pertinencia
✔Ministerio
de Salud - OTIC, sobre inconsistencias en datos reportados a
SISMED, falta de validaciones y analítica
✔Ministerio
de Salud - MiPres, sobre inconsistencias en datos de
Prescripciones y efectos de la Política de Presupuestos Máximos
✔Ministerio
de Salud - Cuenta de Alto Costo, sobre inconsistencias en
Informes publicados y posibles estudios de pertinencia
✔Ministerio
de Salud - Med-Col-STAT, sobre inconsistencias en la Plataforma,
Informes generados y posibles estudios de pertinencia
✔Instituto
Nacional de Salud - Informes publicados y posibles estudios de
pertinencia
✔INVIMA,
sobre inconsistencias en su base de datos, posibles estudios de
pertinencia y Farmacovigilancia
7.
Proyección de cambios estructurales en el sistema de salud
Luego, tomando en cuenta que una normatividad diseñada para la
defensa de los intereses de la salud pública fue desnaturalizada
por un cambio de gobierno y una política pública de "Todo el
poder a las EPS" (dejó de desarrollarse el Banco de la Salud
ADRES, no se amplió el "Giro Directo a Prestadores", se llenó de
inconsistencias al modelo de transparencia de precios y ventas
del mercado farmacéutico de SISMED y se dañó el acceso al
microdato de ventas y prescripción de los CUBOS de SISMED y
MiPres, se frenó el Decreto de Apertura de competencia de
medicamentos Biotecnológicos, al igual que la Resolución de
transparencia en transferencias de valor, etc. y solo para
mencionar los daños más importantes). Es necesario prevenir
estos retrocesos, con NORMATIVIDADES VIRTUOSAS con fuerza de
Ley, como las siguientes:
7.1. Acuerdo No.15 de Política Farmacéutica en
Proyecto de Reforma a la Salud ANM
Las organizaciones más representativas de los médicos
colombianos, presentaron los 14 ACUERDOS FUNDAMENTALES de lo que
consideran esencial para el pleno desarrollo de la Ley
Estatutaria 1751 de 2015 y el Sistema de Salud en ella
establecido.
Gráfico N°25:
Acuerdo
Fundamental N°13 de POLÍTICA FARMACÉUTICA con firma de 21
organizaciones médicas

Acuerdo 13. Política farmacéutica
Avanzar en el desarrollo de la Política
Farmacéutica Nacional (PFN) establecida en el CONPES Social 155
de agosto de 2012, formulada con anterioridad a la expedición de
la Ley Estatutaria en Salud, de tal manera que, la nueva
política despliegue lo ordenado en el artículo 23 de esta ley:
“El Gobierno
Nacional establecerá una Política Farmacéutica Nacional,
programática e integral en la que se identifiquen las
estrategias, prioridades, mecanismos de financiación,
adquisición, almacenamiento, producción, compra y distribución
de los insumos, tecnologías y medicamentos, así como los
mecanismos de regulación de precios de medicamentos. Esta
política estará basada en criterios de necesidad, calidad, costo
efectividad, suficiencia y oportunidad”.
Para el efecto, se propone que la PFN sea:
• Programática,
con metodología científica y objetivos a corto, mediano y largo
plazo.
• Integral,
con elementos de integración horizontal y vertical de las
tecnologías en salud.
• Estratégica,
con vocación de soberanía tecnológica y mecanismos de
transferencia.
• Priorizada,
hacia la defensa de la salud pública y el derecho fundamental a
la salud.
• Optimizada,
en todos sus procesos de adquisición y uso pertinente.
• Sostenible,
con base en la detección y eliminación de falsas innovaciones
tecnológicas, el freno a abusos de posición dominante y la
erradicación de todas las formas de corrupción.
• Sistema
Único e Integrado de Información en Salud, para
garantizar trasparencia con acceso público a la información
epidemiológica y de todas las transacciones económicas.
Después de 9 años de proferido el CONPES 155, el
INVIMA aún mantiene inconsistencias graves en su base de datos
de medicamentos, como el manejo de códigos únicos de
medicamentos para los registros sanitarios vigentes (ATC),
coincidencias de indicaciones por principio activo, data de
titularidad de registros sanitarios, oportunidad de renovaciones
y manejo de fechas de vigencia. A cinco años del Decreto de
apertura de competencia con Biotecnológicos, la plataforma de
Biológicos aún no funciona a la perfección. No muestra la
información de registros sanitarios, no completó la asignación
del Identificador Único del Medicamento (IUM), persiste la falta
de parametrización de datos clave, entre otros aspectos.
Estas deficiencias se transmiten a otros sistemas
de información como el Sistema de Información de Precios de
Medicamentos (SISMED) y la herramienta tecnológica para
prescripción -MIPRES.
En cumplimiento del artículo 23 de la LES, el
INVIMA deberá adelantar políticas de mejor información y
educación sanitaria para la población, exigir mayor
transferencia de tecnología y contribuir al desarrollo de
capacidades nacionales crecientes en pro de mayor seguridad y en
pro de la soberanía farmacéutica.
Así mismo, se avanzará en el control de precios
de medicamentos con base en comparaciones internacionales; se
extenderá progresivamente a medicamentos de alto costo,
innovadores, genéricos, biológicos y biosimilares; control de
precios a insumos de alto costo y a ciertas tecnologías en
salud. Se considerarán las negociaciones centralizadas como
parte de esta política.
Impulsar y promover alianzas y mecanismos de
producción nacional de vacunas, de medicamentos e insumos y
productos básicos en salud, para avanzar en los conceptos de
seguridad, soberanía e independencia farmacéutica y tecnológica.
Declarar exentos de IVA los medicamentos, insumos
y tecnologías básicas en el Sistema de Salud.
Firman:
✔Academia Nacional de Medicina.
Presidente: Gabriel Carrasquilla
Gutiérrez, en representación del grupo de Acuerdos
Fundamentales.
✔Asociación Colombiana de Sociedades Científicas -ACSC. Agamenón
Quintero Villarreal, presidente.
✔Colegio Médico Colombiano -CMC. Stevenson
Marulanda Plata, presidente.
✔Asociación de Profesiones de la Salud -ASSOSALUD. Mauricio
Echeverri Diez, presidente.
✔Federación Odontológica Colombiana -FOC. María
Fernanda Atuesta Mondragón, presidente.
✔Sociedad Colombiana de Anestesiología y
Reanimación -SCARE. Olga Lucía
Herrera Losada, presidente.
✔Asociación Médica Sindical, ASMEDAS Cundinamarca. Jaime
Cuervo Saavedra, secretario general.
✔Colegio Médico de Cundinamarca y Bogotá -CMCB. Clemencia
Mayorga Ramírez, presidente.
✔Colegio Médico de Antioquia. Carlos
Eduardo Valdivieso Gelves, presidente.
✔Colegio Médico de Santander. Sandra
Milena Acevedo Rueda, presidente.
✔Colegio Médico del Cauca. Martha
Sofía Bedoya, presidente.
✔Federación Colombiana de Sindicatos Médicos -FECOLMED. Jorgenrique
Enciso Sánchez, presidente.
✔Academia Nacional de Medicina, Capítulo Nariño. Emma
Guerra Nieto, presidente.
✔Academia de Medicina de Medellín. Giovanni
García Martínez, presidente.
✔Asociación Gremial y Sindical de Cirujanos de
Ortopedia y Traumatología. Roberto
Díaz González, presidente.
✔Federación de Sindicatos de Anestesiología -FSA.
Luis Mauricio García Borrero, presidente.
✔Asociación de Epidemiología de Colombia -ASOCEPIC.
Luis Jorge Hernández Flórez, presidente.
✔Federación Nacional de Prestadores de Servicios
de Salud -FENALSALUD. Joaquín
Enrique Villamizar Zúñiga, presidente.
✔Asociación de Médicos Egresados de la U. del
Valle -AMEUV. Álvaro Bustos
Mejía, presidente.
✔Unión Gremial de Dermatólogos de Colombia. UNIDERMA.
Arturo César Argote, presidente.
✔Academia de Medicina del Valle del Cauca.
Néstor Harry Amorocho Pedraza, presidente.
7.2. Ley 2386 de 25jul24 de SOBERANÍA
FARMACÉUTICA logro de la Sociedad Civil
Al margen de la tendencia de Radicalismo Verbal Maximalista
con Insuficiencia Técnica y Ejecutiva, que llevó al fracaso
el Proyecto de Reforma Estructural a la Salud, organizaciones de
la Sociedad Civil, en una mesa intersectorial coordinada por el
Colegio Nacional de Químicos Farmacéuticos de Colombia,
donde participaron:
✔Asociación
de Industrias Farmacéuticas en Colombia (Asinfar),
✔Asociación
de Laboratorios Farmacéuticos de Investigación y Desarrollo (Afidro),
✔Asociación
Colombiana de la Industria Farmacéutica (Ascif),
✔Cámara
de la Industria Farmacéutica de la Asociación Nacional de
Empresarios (Andi), y
✔Asociación
Colombiana de Programas [de pregrado] de Farmacia, Ascolprofar.
Con el respaldo del Clúster Farmacéutico de la Cámara de
Comercio de Bogotá.
Y la gestión del Senador Pedro Flórez y la Representante
Jennifer Pedraza
Y los Ponentes en Senado Pedro Flórez (Comisión VI y Plenaria) y
en Cámara: Dolcey Torres (Comisión VI y Plenaria)
Demostraron que SÍ era posible aprobar una Ley de Política
Nacional de Investigación Científica, Desarrollo Tecnológico,
Innovación y Producción, de la Industria Farmacéutica para la
AUTONOMÍA sanitaria de Colombia.
Gráfico N°26: Ley 2386 de 25jul24 de
SOBERANÍA FARMACÉUTICA lograda por la Sociedad Civil

Ver
Ley de Política Nacional de Investigación Científica, Desarrollo
Tecnológico, Innovación y Producción de la Industria
Farmacéutica para la Autonomía Sanitaria de Colombia.
7.3.
Sistema Integrado Transaccional y Distribuido de Información en
Salud SITDIS
El Sistema de Información en Salud
debe Integrarse y ser Transaccional y Distribuido.
Ante los cambios sufridos por el proyecto de SUIIS/SPUIIS y
el fracaso del proyecto de Reforma a la Salud en el Congreso
durante 2024, los contenidos de esa página fueron actualizados
para presentar la nueva propuesta de Sistema
de Información Transaccional y Distribuido de Información en
Salud SITDIS.
7.4.
Enlaces de respaldo documental
de DOLUTEGRAVIR y Combinaciones
|
EN CONSTRUCCIÓN -
EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN
EN CONSTRUCCIÓN - EN CONSTRUCCIÓN - EN CONSTRUCCIÓN
|